
50 voorbeelden van zuren en basen

Er zijn honderden voorbeelden van zuren en basen die in alle takken van de chemie te vinden zijn, maar die als geheel worden opgesplitst in twee grote families: anorganisch en organisch. Anorganische zuren staan meestal bekend als minerale zuren, die worden gekenmerkt doordat ze bijzonder sterk zijn in vergelijking met organische zuren..
Onder zuren en basen worden stoffen verstaan die respectievelijk een zure of saponachtige smaak hebben. Beide zijn bijtend, hoewel het woord 'bijtend' vaak wordt gebruikt voor sterke basen. Kort gezegd: ze verbranden en corroderen de huid als ze worden aangeraakt. Zijn kenmerken in oplossende media hebben door de geschiedenis heen geleid tot een reeks definities..
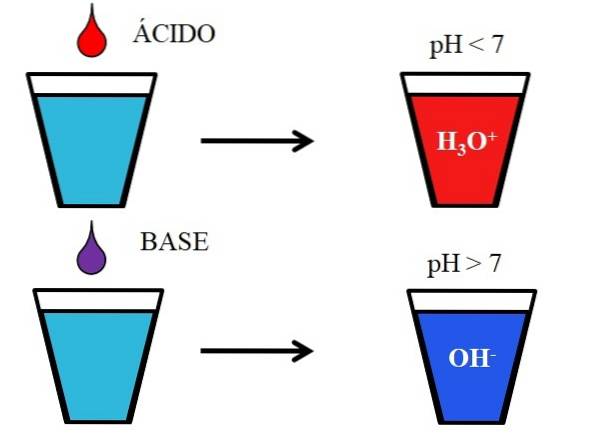
De onderstaande afbeelding toont het algemene gedrag van zuren en basen wanneer ze worden toegevoegd of opgelost in een glas water. Zuren produceren oplossingen met pH-waarden lager dan 7 vanwege hydroniumionen, H.3OF+terwijl de basen oplossingen produceren met een pH hoger dan 7 vanwege de hydroxyl (of hydroxyl) ionen, OH-.
Als we zoutzuur, HCl (rode druppel), aan het glas toevoegen, zullen er H-ionen zijn3OF+ en Cl- gehydrateerd. Aan de andere kant, als we het experiment met natriumhydroxide, NaOH (paarse druppel) herhalen, hebben we OH-ionen- en Na+.
Artikel index
- 1. Definities
- 1.1 Arrhenius
- 1.2 Bronsted-Lowry
- 1.3 Lewis
- 2 Voorbeelden van zuren
- 3 Voorbeelden van bases
- 4 referenties
Definities

De steeds meer bestudeerde en begrepen eigenschappen van zuren en basen hebben meer dan één definitie voor deze chemische verbindingen opgeleverd. Onder deze definities hebben we die van Arrhenius, Bronsted-Lowry en tenslotte die van Lewis. Alvorens de voorbeelden te noemen, is het noodzakelijk hier duidelijk over te zijn.
Arrhenius
Volgens Arrhenius zijn zuren en basen die, wanneer ze in water worden opgelost, H-ionen produceren3OF+ of OH-, respectievelijk. Dat wil zeggen, de afbeelding vertegenwoordigt deze definitie al. Op zichzelf negeert het echter enkele zuren of basen die te zwak zijn om dergelijke ionen te produceren. Dit is waar de Bronsted-Lowry-definitie om de hoek komt kijken..
Bronsted-Lowry
Bronsted-Lowry-zuren zijn zuren die H-ionen kunnen afstaan+, en de basen zijn degenen die deze H accepteren+. Als een zuur heel gemakkelijk zijn H schenkt+, betekent dat het een sterk zuur is. Hetzelfde gebeurt met de basen, maar het accepteren van H+.
We hebben dus sterke of zwakke zuren en basen, en hun krachten worden gemeten in verschillende oplosmiddelen; vooral in water, waaruit de bekende pH-eenheden worden bepaald (van 0 tot 14).
Daarom zal een sterk zuur HA uw H volledig afstaan+ met water in een reactie van het type:
HA + HtweeO => EEN- + H.3OF+
Waarheen- is de geconjugeerde base van HA. Daarom komt de H3OF+ aanwezig in het glas met zure oplossing.
Ondertussen zal een zwakke base B het water deprotoneren om zijn respectievelijke H te verkrijgen+
B + HtweeOF <=> HB + OH-
Waar HB het geconjugeerde zuur is van B. Dit is het geval van ammoniak, NH3
NH3 + H.tweeOF <=> NH4+ + Oh-
Een zeer sterke base kan OH-ionen direct afstaan- zonder de noodzaak om met water te reageren; net als NaOH.
Lewis
Ten slotte zijn Lewis-zuren degenen die elektronen winnen of accepteren, en Lewis-basen zijn degenen die elektronen doneren of verliezen..
Bijvoorbeeld de Bronsted-Lowry NH-basis3 Het is ook een Lewis-base, aangezien het stikstofatoom een H accepteert+ door zijn paar vrije elektronen te doneren (H.3N: H+Dat is de reden waarom de drie definities niet met elkaar oneens zijn, maar eerder met elkaar verweven zijn en helpen bij het bestuderen van zuurgraad en basiciteit in een breder spectrum van chemische verbindingen..
Voorbeelden van zuren
Nadat de definities zijn verduidelijkt, wordt hieronder een reeks zuren met hun respectieve formules en namen vermeld:
-HF: fluorwaterstofzuur
-HBr: broomwaterstofzuur
-HI: joodwaterstofzuur
-H.tweeS: waterstofsulfide
-H.tweeSe: seleenzuur
-H.tweeThee: tellurhydric zuur
Dit zijn de binaire zuren, ook wel hydraciden genoemd, waartoe het eerder genoemde zoutzuur, HCl, behoort.
-HNO3: salpeterzuur
-HNOtwee: salpeterig zuur
-HNO: hyponitrous zuur
-H.tweeCO3: koolzuur
-H.tweeCOtwee: koolstofzuur, dat eigenlijk beter bekend is onder de naam mierenzuur, HCOOH, het eenvoudigste organische zuur van allemaal
-H.3PO4: fosforzuur
-H.3PO3 of Htwee[HPO3]: fosforzuur, met een H-P-binding
-H.3POtwee of H [HtweePOtwee]: hypofosforig zuur, met twee H-P-bindingen
-H.tweeSW4: zwavelzuur
-H.tweeSW3: zwavelig zuur
-H.tweeStweeOF7: zwavelzuur
-HIO4: periodiek zuur
-HIO3: jodiumzuur
-HIOtwee: jodiumzuur
-HIO: hypojoodzuur
-H.tweeCrO4: chroomzuur
-HMnO4: mangaanzuur
-CH3COOH: azijnzuur (azijn)
-CH3SW3H: methaansulfonzuur
Al deze zuren, behalve mierenzuur en de laatste twee, staan bekend als oxaciden of ternaire zuren..
Anderen:
-AlCl3: aluminiumchloride
-FeCl3: ijzerchloride
-BF3: boortrifluoride
-Metallische kationen opgelost in water
-Carbocations
-H (CHBelfClelf): superzuur carboraan
- FSO3H: fluorsulfonzuur
- HSbF6: fluorantimonzuur
- FSO3H SbF5: magisch zuur
De laatste vier voorbeelden vormen de angstaanjagende superzuren; verbindingen die in staat zijn om bijna elk materiaal uiteen te laten vallen door het aan te raken. AlCl3 is een voorbeeld van Lewis-zuur, aangezien het metaalcentrum van aluminium elektronen kan accepteren vanwege zijn elektronische tekortkoming (het voltooit zijn valentie-octet niet).
Voorbeelden van bases
Onder de anorganische basen hebben we metaalhydroxiden, zoals natriumhydroxide, en enkele moleculaire hydriden, zoals ammoniak die al zijn genoemd. Hier zijn andere voorbeelden van bases:
-KOH: kaliumhydroxide
-LiOH: lithiumhydroxide
-RbOH: rubidiumhydroxide
-CsOH: cesiumhydroxide
-FrOH: francium hydroxide
-Wees (OH)twee: berylliumhydroxide
-Mg (OH)twee: magnesium hydroxide
-Ca (OH)twee: calcium hydroxide
-Sr (OH)twee: strontiumhydroxide
-Ba (OH)twee: bariumhydroxide
-Ra (OH)twee: radiumhydroxide
-Fe (OH)twee: ijzer (II) hydroxide
-Fe (OH)3: ijzer (III) hydroxide
-Al (OH)3: aluminium hydroxide
-Pb (OH)4: loodhydroxide
-Zn (OH)twee: zinkhydroxide
-Cd (OH)twee: cadmiumhydroxide
-Cu (OH)twee: koper (II) hydroxide
-Ti (OH)4: titaanhydroxide
-PH3: fosfine
-As3: arsine
-NaNHtwee: natriumamide
- C5H.5N: pyridine
-(CH3) N: trimethylamine
- C6H.5NHtwee: fenylamine of aniline
-NaH: natriumhydride
-KH: kaliumhydride
-Carbanions
-Li3N: lithiumnitride
-Alkoxiden
-[(CH3tweeCH]tweeNLi: lithiumdiisopropylamide
-Diethynylbenzeen anion: C6H.4C4twee- (de sterkste basis die tot nu toe bekend is)
Referenties
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8e ed.). CENGAGE Leren.
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). Mc Graw Hill.
- Naomi Hennah. (10 oktober 2018). Hoe zuren, basen en zouten te leren. Hersteld van: edu.rsc.org
- Helmenstine, Anne Marie, Ph.D. (31 augustus 2019). Formules van gewone zuren en basen. Hersteld van: thoughtco.com
- David Wood. (2019). Vergelijking van gewone zuren en basen. Studie. Hersteld van: study.com
- Ross Pomeroy. (23 augustus 2013). De sterkste zuren ter wereld: zoals vuur en ijs. Hersteld van: realclearscience.com
- Wikipedia. (2019). Diethynylbenzeen dianion. Hersteld van: en.wikipedia.org



Niemand heeft nog op dit artikel gereageerd.