
Isopropylalcohol structuur, eigenschappen, synthese en toepassingen
De isopropylalcohol of isopropanol is een organische verbinding waarvan de chemische formule CH is3CHOHCH3 of (CH3tweeCHOH. Het behoort tot een van de belangrijkste families in de organische chemie: alcoholen, zoals de naam al aangeeft..
Het is een vloeibare, kleurloze, sterk ruikende, vluchtige en brandbare chemische verbinding. Het is tegelijkertijd een zwak zuur en een base, vergelijkbaar met water, afhankelijk van de pH van de oplossing en / of de aanwezigheid van een zuur of een base die sterker is dan deze. Dampen van isopropylalcohol veroorzaken een zeer milde irritatie van het slijmvlies van neus, keel en ogen..
Isopropylalcohol wordt gebruikt als hoofdingrediënt in verschillende producten in de farmaceutische, chemische, commerciële en huishoudelijke industrieën. Vanwege zijn antimicrobiële eigenschappen wordt het veel gebruikt als antisepticum op de huid en slijmvliezen, en als desinfectiemiddel in inerte materialen..
Het is erg handig als oplosmiddel, omdat het een lage toxiciteit heeft, en het wordt ook gebruikt als benzineadditief..
Evenzo is het de grondstof voor de synthese van andere organische verbindingen door de hydroxyl (OH) functionele groep te vervangen. Op deze manier is deze alcohol erg bruikbaar en veelzijdig om andere organische verbindingen te verkrijgen; zoals alkoxiden, alkylhalogeniden en andere chemische verbindingen.
Artikel index
- 1 Structuur van isopropylalcohol of isopropanol
- 2 Fysische en chemische eigenschappen
- 2.1 Molecuulgewicht
- 2.2 Fysiek uiterlijk
- 2.3 Geur
- 2.4 Smeltpunt
- 2.5 Kookpunt
- 2.6 Dichtheid
- 2.7 Oplosbaarheid
- 2,8 pKa
- 2.9 Geconjugeerde basis
- 2.10 Absorptie
- 3 Nomenclatuur
- 4 Synthese
- 5 toepassingen
- 5.1 Samengevat
- 5.2 Voor reiniging
- 5.3 Antimicrobieel
- 5.4 Geneeskunde
- 5.5 Oplosmiddel
- 6 referenties
Structuur van isopropylalcohol of isopropanol
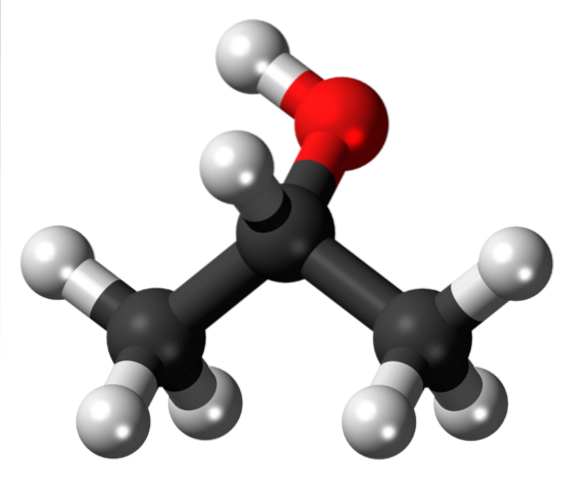
De bovenste afbeelding toont de structuur van isopropylalcohol of isopropanol met een model van bollen en staven. De drie grijze bollen stellen de koolstofatomen voor, die de isopropylgroep vormen, gehecht aan een hydroxylgroep (rode en witte bollen).
Zoals alle alcoholen bestaan ze structureel uit een alkaan; in dit geval propaan. Dit geeft alcohol het kenmerk van lipofiel (vermogen om vetten op te lossen gezien de affiniteit ervoor). Het is gehecht aan een hydroxylgroep (-OH), die aan de andere kant de structuur de hydrofiele eigenschap geeft.
Daarom kan isopropylalcohol vet of vlekken oplossen. Merk op dat de -OH-groep is gehecht aan het middelste koolstofatoom (2e, dat wil zeggen gehecht aan twee andere koolstofatomen), wat aangeeft dat deze verbinding een secundaire alcohol is.
Het kookpunt is lager dan dat van water (82,6 ° C), wat te verklaren is uit het propaanskelet, dat door Londense dispersiekrachten nauwelijks met elkaar in wisselwerking kan treden; lager dan waterstofbruggen (CH3tweeCHO-H - H-O-CH (CH3twee.
Fysische en chemische eigenschappen
Molecuulgewicht
60,10 g / mol.
Fysiek uiterlijk
Vloeibaar en kleurloos en brandbaar.
Geur
Sterke geur
Smeltpunt
-89 ° C.
Kookpunt
82,6 ° C.
Dichtheid
0,786 g / ml bij 20 ° C.
Oplosbaarheid
Het is oplosbaar in water en oplosbaar in organische verbindingen zoals chloroform, benzeen, ethanol, glycerine, ether en aceton. Het is onoplosbaar in zoutoplossingen.
pKa
17
Geconjugeerde basis
(CH3tweeCHO-
Absorptie
Isopropylalcohol in het zichtbare ultraviolette spectrum heeft een maximale absorptie bij 205 nm.
Nomenclatuur
In de nomenclatuur van organische verbindingen zijn er twee systemen: die van gewone namen en het internationaal gestandaardiseerde IUPAC-systeem..
Isopropylalcohol komt overeen met de algemene naam, eindigend op het achtervoegsel -ico, voorafgegaan door het woord alcohol en met de naam van de alkylgroep. De alkylgroep bestaat uit 3 koolstofatomen, twee methyluiteinden en degene in het midden gehecht aan de -OH-groep; d.w.z. isopropylgroep.
Isopropylalcohol of isopropanol heeft andere namen zoals onder andere 2-propanol, sec-propylalcohol; maar volgens de IUPAC-nomenclatuur wordt het propaan-2-ol genoemd.
Volgens deze nomenclatuur is het eerst 'propaan' omdat de koolstofketen drie koolstofatomen bevat of is opgebouwd.
Ten tweede wordt de positie van de OH-groep op de koolstofketen aangegeven met een nummer; in dit geval is het 2.
De naam eindigt op 'ol', kenmerkend voor organische verbindingen van de alcoholfamilie omdat ze de hydroxylgroep (-OH) bevatten.
De naam isopropanol wordt door de IUPAC als onjuist beschouwd vanwege de afwezigheid van het koolwaterstofisopropaan.
Synthese
De chemische synthesereactie van isopropylalcohol op industrieel niveau is in feite een watertoevoegingsreactie; dat wil zeggen, hydratatie.
Het uitgangsproduct voor de synthese of het verkrijgen is propeen, waaraan water wordt toegevoegd. Propeen CH3-CH = CHtwee Het is een alkeen, een koolwaterstof afgeleid van aardolie. Door hydratatie wordt waterstof (H) vervangen door een hydroxylgroep (OH).
Water wordt in aanwezigheid van zuren aan het alkeenpropeen toegevoegd om isopropanolalcohol te produceren..
Er zijn twee manieren om het te hydrateren: de directe en de indirecte, uitgevoerd onder polaire omstandigheden, waarbij isopropanol wordt gegenereerd..
CH3-CH = CHtwee (Propeen) => CH3CHOHCH3 (Isopropanol)
Bij directe hydratatie, in de gas- of vloeistoffase, wordt propeen gehydrateerd door zure katalyse onder hoge druk.
Bij indirecte hydratatie reageert propeen met zwavelzuur, waarbij sulfaatesters worden gevormd die door hydrolyse isopropylalcohol produceren.
Isopropylalcohol wordt ook verkregen door aceton in de vloeistoffase te hydrogeneren. Deze processen worden gevolgd door destillatie om de alcohol van het water te scheiden, waardoor watervrije isopropylalcohol ontstaat met een opbrengst van ongeveer 88%..
Toepassingen
Isopropylalcohol heeft een breed scala aan toepassingen op chemisch niveau. Het is handig voor het maken van andere chemische verbindingen. Het heeft tal van toepassingen op industrieel niveau, voor het reinigen van apparatuur, op medisch niveau, in huishoudelijke producten en voor cosmetisch gebruik..
Deze alcohol wordt onder andere gebruikt in parfums, haarkleurmiddelen, lakken, zepen, zoals je hieronder zult zien. Het gebruik ervan is voornamelijk en in wezen extern, aangezien het inademen of inslikken zeer giftig is voor levende wezens.
samengevat
Daaruit kunnen alkylhalogeniden worden verkregen door in het algemeen broom (Br) of chloor (Cl) te substitueren, de functionele groep alcohol (OH).
Door een oxidatieproces van isopropylalcohol met chroomzuur uit te voeren, kan aceton ontstaan. Het kan alkoxiden vormen als gevolg van de reactie van isopropylalcohol met sommige metalen zoals kalium.
Voor schoonmaken
Isopropylalcohol is ideaal voor het reinigen en onderhouden van onder meer optische brillen zoals lenzen en elektronische apparatuur. Deze alcohol verdampt snel, laat geen resten of sporen achter en is niet giftig bij toepassingen of uitwendig gebruik.
Antimicrobieel
Isopropanol heeft antimicrobiële eigenschappen, veroorzaakt denaturatie van bacteriële eiwitten, lost onder andere lipoproteïnen van het celmembraan op.
Als antisepticum wordt isopropylalcohol op de huid en slijmvliezen aangebracht en verdampt het snel, waardoor een verkoelend effect ontstaat. Het wordt gebruikt om kleine operaties uit te voeren, het inbrengen van naalden, katheters en andere invasieve procedures. Bovendien wordt het gebruikt als ontsmettingsmiddel voor medische instrumenten.
Geneesmiddel
Afgezien van het gebruik als antimicrobieel middel, is het vereist in laboratoria voor reiniging, conservering van monsters en DNA-extractie..
Deze alcohol is ook erg handig bij de bereiding van farmacologische producten. Isopropylalcohol wordt gemengd met geurstoffen en etherische oliën en wordt in therapeutische verbindingen gebruikt om op het lichaam te wrijven.
Oplosmiddel
Isopropylalcohol heeft de eigenschap bepaalde oliën, natuurlijke harsen, gommen, alkaloïden, ethylcellulose en andere chemische verbindingen op te lossen.
Referenties
- Carey, F. A. (2006). Organische chemie zesde editie. Mc Graw Hill Publishing House
- Morrison, R. en Boyd, R. (1990). Organische chemie. Vijfde editie. Redactioneel Addison-Wesley Iberoamericana.
- PubChem. (2019). Isopropylalcohol. Hersteld van: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2018). Isopropylalcohol. Hersteld van: en.wikipedia.org
- Wade, L. (5 april 2018). Isopropylalcohol. Encyclopaedia Britannica. Hersteld van: britannica.com


Niemand heeft nog op dit artikel gereageerd.