
Anisoolstructuur, eigenschappen, nomenclatuur, risico's en toepassingen
De anisol of methoxybenzeen is een organische verbinding die bestaat uit een aromatische ether waarvan de chemische formule C is6H.5OCH3. Zijn fysische toestand is die van een kleurloze vloeistof, die gelige verkleuring kan vertonen. Het is gemakkelijk te herkennen aan zijn karakteristieke anijsgeur.
Het is dan een vluchtige verbinding en niet erg hoge cohesiekrachten; typische kenmerken van lichte ethers, die worden bewaard in kleine verzegelde containers. Specifiek is anisol de eenvoudigste van de alkylethers; dat wil zeggen die met een aromatische component (Ar) en een andere alkylcomponent (R), Ar-O-R.
Groep C6H.5- komt om Ar aan te duiden, en -CH3 naar R, dus met C6H.5-O-CH3. De aromatische ring en de aanwezigheid van -OCH3 Als een substituentgroep die methoxy wordt genoemd, geeft het anisol een nucleofiliciteit die superieur is aan die van benzeen en nitrobenzeen. Daarom dient het als een tussenmolecuul voor de synthese van verbindingen met farmacologische activiteit..
De karakteristieke anijsgeur is gebruikt om anisole toe te voegen aan cosmetische en hygiëneproducten die een aangename geur vereisen..
Artikel index
- 1 Structuur van anisole
- 1.1 Dipoolmoment
- 1.2 Kristallen
- 2 Eigenschappen
- 2.1 Fysiek uiterlijk
- 2.2 Geur
- 2.3 Smaak
- 2.4 Molecuulmassa
- 2.5 Dichtheid
- 2.6 Dampdichtheid
- 2.7 Smeltpunt
- 2.8 Kookpunt
- 2.9 Vlampunt
- 2.10 Zelfontbrandingstemperatuur
- 2.11 Viscositeit
- 2.12 Oppervlaktespanning
- 2.13 Brekingsindex
- 2.14 Oplosbaarheid
- 2.15 nucleofiliciteit
- 2.16 Reactiviteit
- 3 Nomenclatuur
- 4 Risico's
- 5 toepassingen
- 5.1 Organische syntheses
- 5.2 Geuren
- 6 referenties
Anisole structuur
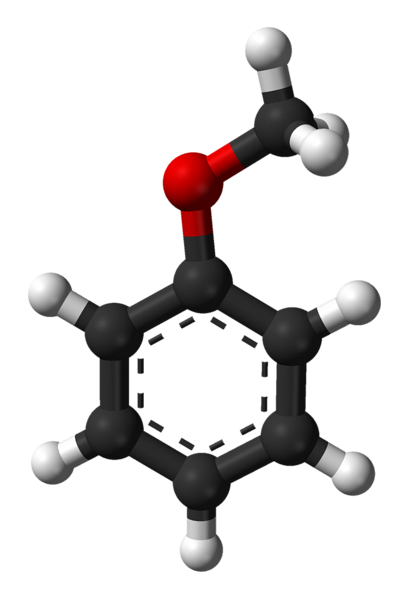
De bovenste afbeelding toont de moleculaire structuur van anisool met behulp van een bolletjes- en staafmodel. De aromatische ring wordt gewaardeerd, waarvan de koolstofatomen sptwee en daarom is het plat, als een zeshoekig vel; en daaraan gehecht is de methoxygroep, waarvan het koolstofatoom sp is3, en zijn waterstofatomen zijn boven of onder het ringvlak.
Het belang van de -OCH-groep3 in de structuur gaat het verder dan het breken met de vlakke geometrie van het molecuul: het verleent er polariteit aan, en bijgevolg krijgt het apolaire molecuul benzeen een permanent dipoolmoment.
Dipool moment
Dit dipoolmoment is te wijten aan het zuurstofatoom, dat de elektronendichtheden van zowel de aromatische als de methylring aantrekt. Hierdoor kunnen anisoolmoleculen interageren via dipool-dipoolkrachten; Hoewel het elke mogelijkheid mist om waterstofbruggen te vormen, omdat het een ether is (ROR heeft geen H gekoppeld aan zuurstof).
Het hoge kookpunt (154ºC) bevestigt experimenteel de sterke intermoleculaire interacties die de vloeistof beheersen. Evenzo zijn de Londense dispersiekrachten aanwezig, afhankelijk van de molecuulmassa, en de π-π-interacties tussen de ringen zelf.
Kristallen
Door de structuur van anisool kan het echter niet sterk genoeg interageren om een vaste stof aan te nemen bij kamertemperatuur (mp = -37ºC). Dit kan ook het gevolg zijn van het feit dat wanneer de intermoleculaire afstanden worden verkleind, de elektrostatische afstoting tussen de elektronen van naburige aromatische ringen veel kracht begint te krijgen..
Daarom, en volgens kristallografische studies, kunnen de anisoolmoleculen in kristallen bij een temperatuur van -173ºC niet zo worden gerangschikt dat hun ringen naar elkaar toe zijn gericht; dat wil zeggen, hun aromatische centra zijn niet op elkaar uitgelijnd, maar eerder een groep -OCH3 is boven of onder een aangrenzende ring.
Eigendommen
Fysiek uiterlijk
Kleurloze vloeistof maar die kan lichte strokleurige tinten hebben.
Geur
Ruikt enigszins naar anijszaadjes.
Smaak
Snoep; het is echter matig giftig, dus deze test is gevaarlijk.
Moleculaire massa
108,140 g / mol.
Dichtheid
0,995 g / ml.
Dampdichtheid
3,72 (ten opzichte van lucht = 1).
Smeltpunt
-37ºC.
Kookpunt
154ºC.
ontstekingspunt
125ºC (open beker).
Zelfontbranding temperatuur
475 ° C.
Viscositeit
0,778 cP bij 30 ° C.
Oppervlaktespanning
34,15 dynes / cm bij 30ºC.
Brekingsindicator
1.5179 bij 20ºC.
Oplosbaarheid
Slecht oplosbaar in water (ongeveer 1 mg / ml). In andere oplosmiddelen, zoals aceton, ethers en alcoholen, is het echter zeer goed oplosbaar.
Nucleofiliciteit
De aromatische ring van anisol is rijk aan elektronen. Dit komt omdat zuurstof, ondanks dat het een sterk elektronegatief atoom is, met de elektronen uit zijn π-wolk bijdraagt om ze door de ring te verplaatsen in talloze resonantiestructuren. Bijgevolg reizen meer elektronen door het aromatische systeem en daarom neemt de nucleofiliteit ervan toe..
De toename van de nucleofiliciteit is experimenteel aangetoond door de reactiviteit ervan, tegen aromatische elektrofiele substituties, te vergelijken met die van benzeen. Het opmerkelijke effect van de -OCH-groep wordt dus bewezen.3 op de chemische eigenschappen van de verbinding.
Evenzo moet worden opgemerkt dat de elektrofiele substituties optreden in de posities naast (-orto) en tegenover (-para) van de methoxygroep; dat wil zeggen, het is ortho-para-directeur.
Reactiviteit
De nucleofiliciteit van de aromatische ring van anisool laat al een glimp van zijn reactiviteit toe. De substituties kunnen voorkomen in de ring (begunstigd door zijn nucleofiliciteit) of in de methoxygroep zelf; in de laatste is de O-CH-binding verbroken3 om de -CH te vervangen3 door een andere alkylgroep: O-alkylering.
Daarom kan het anisol in een alkyleringsproces een R-groep (fragment van een ander molecuul) accepteren door een H op zijn ring te substitueren (C-alkylering), of door de CH3 van zijn methoxygroep. De volgende afbeelding illustreert wat er zojuist is gezegd:
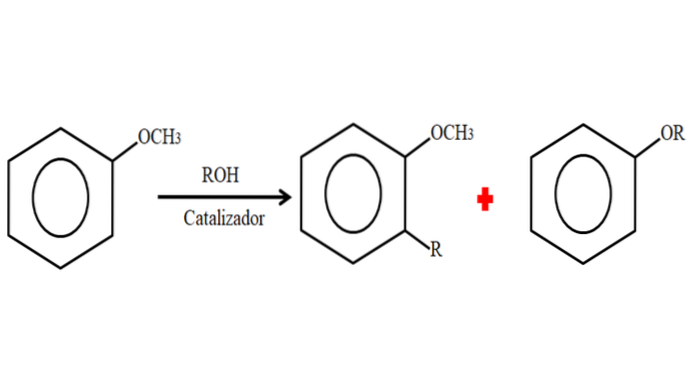
In de afbeelding bevindt de R-groep zich in de -orto-positie, maar hij kan ook in de -para-positie staan, tegenover de -OCH3. Wanneer O-alkylering plaatsvindt, wordt een nieuwe ether met een andere -OR-groep verkregen.
Nomenclatuur
De naam 'anisole' is de bekendste en meest geaccepteerde naam, waarschijnlijk afgeleid van de anijsachtige geur. De naam 'methoxybenzeen' is echter vrij specifiek, aangezien het meteen vaststelt wat de structuur en identiteit is van deze aromatische ether; dit is de naam die wordt beheerst door de systematische nomenclatuur.
Een andere minder gebruikte maar even geldige naam is 'fenylmethylether', die wordt beheerst door de traditionele nomenclatuur. Dit is misschien wel de meest specifieke naam van allemaal, omdat het direct aangeeft welke de twee structurele delen van de ether zijn: fenyl-O-methyl, C6H.5-O-CH3.
Risico's
Medische studies hebben de mogelijke dodelijke effecten van anisol in het lichaam bij lage doses nog niet kunnen aantonen. Echter, zoals bijna alle chemicaliën, veroorzaakt het irritatie wanneer het te lang en in matige concentraties wordt blootgesteld aan de huid, keel, longen en ogen..
Vanwege de nucleofiliciteit van de ring wordt een deel ervan gemetaboliseerd en daarom biologisch afbreekbaar. In feite hebben simulaties als resultaat van deze eigenschap aangetoond dat het zich niet kan concentreren in waterige ecosystemen aangezien zijn organismen het eerst afbreken; en daarom kunnen rivieren, meren of zeeën anisole accumuleren.
In bodems verdampt het, gezien zijn vluchtigheid, snel en wordt het meegevoerd door luchtstromen; als dat zo is, heeft het ook geen grote invloed op de plantaardige massa's of plantages.
Aan de andere kant reageert het atmosferisch met vrije radicalen en vormt het daarom geen risico op besmetting van de lucht die we inademen..
Toepassingen
Organische syntheses
Van anisool kunnen andere derivaten worden verkregen door aromatische elektrofiele substitutie. Dit maakt het mogelijk om het te gebruiken als tussenproduct voor de synthese van geneesmiddelen, pesticiden en oplosmiddelen, waaraan het gewenst is om zijn kenmerken toe te voegen. Synthetische routes kunnen voornamelijk bestaan uit C-alkylering of O-alkylering.
Geuren
Naast het gebruik voor organische synthese, kan het direct worden gebruikt als additief voor crèmes, zalven en parfums, waarbij anijsgeuren aan dergelijke producten worden toegevoegd..
Referenties
- Morrison, R. T. en Boyd, R, N. (1987). Organische chemie. 5e editie. Redactioneel Addison-Wesley Interamericana.
- Carey F. A. (2008). Organische chemie. (Zesde editie). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organische chemie. Amines. (10e editie.). Wiley plus.
- Nationaal centrum voor informatie over biotechnologie. (2019). Anisole. PubChem-database, CID = 7519. Hersteld van: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2019). Anisole. Hersteld van: en.wikipedia.org
- Pereira, Cynthia C. M., de la Cruz, Marcus H. C., & Lachter, Elizabeth R. (2010). Vloeibare fase-alkylering van anisol en fenol gekatalyseerd door niobiumfosfaat. Journal of the Brazilian Chemical Society, 21 (2), 367-370. dx.doi.org/10.1590/S0103-50532010000200025
- Seidel R. W. en Goddard R. (2015). Anisool op 100 K: de eerste bepaling van de kristalstructuur. Acta Crystallogr C Struct Chem. Aug; 71 (Pt 8): 664-6. doi: 10.1107 / S2053229615012553
- Chemische formulering. (2018). Methoxybenzeen Hersteld van: Formulacionquimica.com



Niemand heeft nog op dit artikel gereageerd.