
Antimoonhistorie, structuur, eigenschappen, gebruik en risico's
De antimoon Het is een glanzende, zilveren metalloïde met een bepaalde blauwachtige tint. Zijn vaste stof wordt ook gekenmerkt door zijn zeer bros en schilferige textuur. Het behoort tot groep 15 van het periodiek systeem, geleid door stikstof. Na bismut (en moscovium) is het het zwaarste element van de groep.
Het wordt weergegeven door het chemische symbool Sb. In de natuur wordt het voornamelijk aangetroffen in minerale ertsen van stibiet en ullmanniet, waarvan de chemische formules Sb zijn.tweeS3 en NiSbS, respectievelijk. Zijn sterke neiging om sulfiden te vormen in plaats van oxiden is te wijten aan zijn chemisch zacht.

Aan de andere kant is antimoon ook fysiek zacht, met een hardheid van 3 op de schaal van Mohs. Het is stabiel bij kamertemperatuur en reageert niet met zuurstof in de lucht. Maar bij verhitting in aanwezigheid van zuurstof vormt het antimoontrioxide, SbtweeOF3.
Evenzo is het bestand tegen de werking van zwakke zuren; maar als het warm is, wordt het aangetast door salpeterzuur en zoutzuur.
Antimoon kent tal van toepassingen, waaronder het wordt gebruikt in legeringen met lood en tin, bij de fabricage van autoaccu's, materialen met lage wrijving, enz..
Dit metalloïde heeft de zeldzame eigenschap dat het in volume toeneemt wanneer het stolt, waardoor zijn legeringen de ruimte die wordt gebruikt om het te vervaardigen instrument te vormen, volledig kunnen innemen..
Artikel index
- 1 Geschiedenis van zijn ontdekking
- 1.1 Voor Christus
- 1.2 Introductie van de term
- 1.3 Verkrijgen
- 2 Structuur van antimoon
- 2.1 Allotropia
- 3 Eigenschappen
- 3.1 Atoomgewicht
- 3.2 atoomnummer
- 3.3 Elektronische configuratie
- 3.4 oxidatietoestanden
- 3.5 Fysieke beschrijving
- 3.6 Smeltpunt
- 3.7 Kookpunt
- 3.8 Dichtheid
- 3.9 Warmte van fusie
- 3.10 Verdampingswarmte
- 3.11 Molaire warmtecapaciteit
- 3.12 Elektronegativiteit
- 3.13 Atoomradius
- 3.14 Hardheid
- 3.15 Stabiliteit
- 3.16 Isotopen
- 3.17 Elektrische en thermische geleidbaarheid
- 3.18 Chemische reactiviteit
- 4 toepassingen
- 4.1 Legeringen
- 4.2 Brandvertragend
- 4.3 Elektronicaveld
- 4.4 Geneeskunde en diergeneeskunde
- 4.5 Pigmenten en verven
- 4.6 Andere toepassingen
- 5 Risico's
- 6 referenties
Geschiedenis van zijn ontdekking
BC
Er zijn aanwijzingen dat sinds 3100 voor Christus antimoonsulfide in Egypte als cosmetisch middel werd gebruikt. In Mesopotamië, het huidige Irak, werden resten van een vaas en een ander artefact gevonden dat vermoedelijk tussen 3000 en 2200 voor Christus dateert, waarin antimoon werd gebruikt bij de uitwerking ervan.
Introductie van de term
De Romeinse geleerde Plinius de Oudere (23-79 n.Chr.) Beschreef het gebruik van antimoon, dat hij stibius noemde, bij de uitwerking van zeven medicijnen in zijn Traatise on Natural History. De alchemist Abu Mussa Jahir Ibn Hayyan (721-815) wordt gecrediteerd met de introductie van de term antimoon om het element te noemen.
Hij gebruikte de volgende etymologie: 'anti' als synoniem voor negatie, en 'mono' alleen voor. Vervolgens wilde hij benadrukken dat antimoon niet alleen in de natuur voorkomt. Het is al bekend dat het deel uitmaakt van sulfidemineralen, evenals vele andere elementen.
Het verkrijgen van
Aangenomen wordt dat de Griekse naturist Pedanius Diascorides zuiver antimoon heeft verkregen door antimoonsulfide in een luchtstroom te verhitten. De Italiaanse metallurg Vannocio Biringucio beschrijft in het boek De la Pirotecnia (1540) een methode om antimoon te isoleren.
De Duitse chemicus Andreas Libavius (1615) bereikte de productie van een kristallijn antimoon door een gesmolten mengsel van ijzer, antimoonsulfide, zout en kaliumtartraat te gebruiken..
Het eerste gedetailleerde rapport over antimoon werd in 1707 gemaakt door de Franse chemicus Nicolas Lemery (1645-1715), in zijn boek Treatise on Antimony.
Antimoon structuur
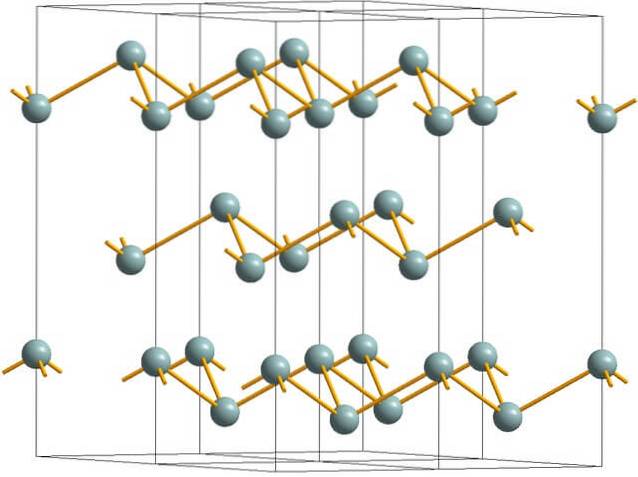
De bovenste afbeelding toont de gerimpelde gelaagde structuur die wordt aangenomen door arseenatomen. Maar ook grijsachtig antimoon, beter bekend als metallisch antimoon, neemt deze structuur aan. Er wordt gezegd dat het "gerimpeld" is omdat er Sb-atomen zijn die stijgen en dalen uit het vlak dat uit de laag bestaat.
Deze lagen, hoewel ze verantwoordelijk zijn voor de fotonen die ermee in wisselwerking staan, schijnen zilverachtige glans, waardoor antimoon als een metaal doorgaat, de waarheid is dat de krachten die ze verenigen zwak zijn; vandaar dat de schijnbare metaalfragmenten van Sb gemakkelijk vermalen en bros of schilferig kunnen zijn.
Ook zijn de Sb-atomen in de gerimpelde lagen niet dichtbij genoeg om hun atomaire orbitalen te groeperen om een band te creëren die elektrische geleiding mogelijk maakt..
Als we afzonderlijk naar een grijsachtige bol kijken, kunnen we zien dat deze drie Sb-Sb-bindingen heeft. Vanuit een hoger vlak was Sb te zien in het midden van een driehoek, met drie Sb op de hoekpunten. De driehoek is echter niet vlak en heeft twee niveaus of verdiepingen..
Door de laterale reproductie van dergelijke driehoeken en hun bindingen ontstaan gerimpelde lagen, die op één lijn liggen om rhombohedrale kristallen te vormen..
Allotropie
De zojuist beschreven structuur komt overeen met grijsachtig antimoon, de meest stabiele van zijn vier allotropen. De andere drie allotropen (zwart, geel en explosief) zijn metastabiel; dat wil zeggen, ze kunnen bestaan onder zeer zware omstandigheden.
Er is niet veel informatie over hun structuren. Het is echter bekend dat zwart antimoon amorf is, dus de structuur is rommelig en ingewikkeld..
Geel antimoon is stabiel onder -90 ° C, gedraagt zich als een niet-metallisch element en kan worden verondersteld te bestaan uit kleine Sb-type agglomeraten4 (vergelijkbaar met die van fosfor); bij verhitting verandert het in de zwarte allotroop.
En wat betreft explosief antimoon, het bestaat uit een geleiachtige afzetting gevormd op de kathode tijdens de elektrolyse van een waterige oplossing van een antimoonhalogenide..
Bij de minste sterke wrijving of impact geeft de zachte vaste stof zoveel warmte af dat het explodeert en stabiliseert terwijl de atomen zich hergroeperen in de rhombohedrale kristallijne structuur van grijsachtig antimoon..
Eigendommen
Atoomgewicht
121,76 g / mol.
Atoomnummer
51.
Elektronische configuratie
[Kr] 4d105stwee5 p3.
Oxidatietoestanden
-3, -2, -1, +1, +2, +3, +4, +5.
Fysieke beschrijving
Glanzende zilveren vaste stof, broos, met een geschubd oppervlak, met een blauwachtige tint. Het kan ook verschijnen als een zwart poeder.
Smeltpunt
630,63 ºC.
Kookpunt
1.635 ºC.
Dichtheid
-6,697 g / cm3 op kamertemperatuur.
-6,53 g / cm3 in vloeibare toestand, temperatuur gelijk aan of hoger dan het smeltpunt.
Warmte van fusie
19,79 kJ / mol.
Warmte van verdamping
193,43 kJ / mol.
Molaire warmtecapaciteit
25,23 J / mol.K
Elektronegativiteit
2.05 (Pauling-schaal).
Atomaire radio
140 uur.
Hardheid
Het is een zacht element, met een hardheid van 3 op de schaal van Mohs en kan door glas worden bekrast.
Stabiliteit
Het is stabiel bij kamertemperatuur en ondergaat geen oxidatie. Het is ook bestand tegen zuuraanvallen.
Isotopen
Het heeft twee stabiele isotopen: 121SB en 123Sb. Daarnaast zijn er 35 radioactieve isotopen. De radioactieve isotoop 125Sb is degene met de langste halfwaardetijd: 2,75 jaar. Over het algemeen zenden radioactieve isotopen β-straling uit+ en β-.
Elektrische en thermische geleidbaarheid
Antimoon is een slechte geleider van warmte en elektriciteit.
Chemische reactiviteit
Het kan geen waterstof uit verdunde zuren verdringen. Vormt ionische complexen met organische en anorganische zuren. Metallisch antimoon reageert niet met lucht, maar wordt in vochtige lucht snel omgezet in oxide..
Halogenen en sulfiden oxideren antimoon gemakkelijk als het proces plaatsvindt bij verhoogde temperaturen.
Toepassingen
Legeringen
Antimoon wordt gebruikt in een legering met lood om platen voor autoaccu's te maken, waardoor de weerstand van de platen wordt verbeterd, evenals de kenmerken van de ladingen..
De legering met lood en tin is gebruikt om de eigenschappen van lassen te verbeteren, evenals die van tracerkogels en patroonontstekers. Het wordt ook gebruikt in legeringen voor het coaten van elektrische kabels..
Antimoon wordt gebruikt in antifrictielegeringen, bij de vervaardiging van tin en verhardende legeringen met een laag tingehalte bij de vervaardiging van orgels en andere muziekinstrumenten..
Het heeft, net als water, het kenmerk dat het in volume toeneemt wanneer het condenseert; Daarom vult het antimoon dat aanwezig is in de legeringen met lood en tin alle ruimtes in de mallen, waardoor de definitie van de structuren die met de genoemde legeringen zijn gemaakt, wordt verbeterd..
Brandvertragend
Antimoontrioxide wordt gebruikt om brandvertragende verbindingen te maken, altijd in combinatie met gehalogeneerde brandvertragers, bromiden en chloriden..
Brandvertragers kunnen reageren met zuurstofatomen en OH-radicalen, wat brand remt. Deze vlamvertragers worden gebruikt in kinderkleding, speelgoed, vliegtuigen en in autostoelen.
Ze worden ook toegevoegd in polyesterharsen en in glasvezelcomposieten voor items die worden gebruikt als hoezen voor lichte vliegtuigmotoren..
Antimoonverbindingen die worden gebruikt als brandvertragers zijn onder meer: antimoon oxychloride, SbOCl; antimoonpentoxide, SbO5antimoontrichloride, SbCl3en antimoontrioxide, SbO3.
Elektronica veld
Het wordt gebruikt bij de fabricage van halfgeleiders, diodes, mid-infrarood detectoren en bij de fabricage van transitors. Antimoon met een hoge zuiverheid, dat wordt gebruikt in de halfgeleidertechnologie, wordt verkregen door antimoonverbindingen te reduceren met waterstof.
Geneeskunde en diergeneeskunde
Antimoonverbindingen worden al sinds de oudheid in de geneeskunde gebruikt als emetica en antiprotozoa. Kaliumkaliumtartraat (tandsteen-braakmiddel) werd lange tijd als antischistosoom gebruikt; wordt bovendien gebruikt als slijmoplossend middel, zweetdrijvend en braakmiddel.
Antimoonzouten zijn ook gebruikt bij het verzorgen van de huid van herkauwers; zoals aniomaline en lithiumantimoontiomalaat.
Meglumine-antimoniate is een medicijn dat wordt gebruikt bij de behandeling van leishmaniasis in uitwendige foci van huisdieren. Hoewel de therapeutische voordelen beperkt waren.
Pigmenten en verven
Antimoonverbindingen worden gebruikt bij de vervaardiging van verven en ondoorzichtig makende middelen in email. Ze worden ook gebruikt in vermiljoen, gele en oranje pigmenten, die producten zijn van de langzame oxidatie van antimoonsulfiden..
Sommige van zijn organische zouten (tartraten) worden in de textielindustrie gebruikt om te helpen bij het binden van bepaalde kleurstoffen.
Antimoonsulfide werd in het oude Egypte gebruikt als cosmetisch middel om de ogen donkerder te maken.
Andere gebruiken
Sommige antimoonzouten worden gebruikt als bekledingsmiddelen om microscopisch kleine belletjes te verwijderen die zich op televisieschermen vormen. Antimoonionen werken samen met zuurstof, waardoor de neiging om bellen te vormen wordt geëlimineerd.
Antimoon (III) sulfide wordt gebruikt in de hoofden van sommige veiligheidslucifers. Antimoonsulfide wordt ook gebruikt om de wrijvingscoëfficiënt van materialen die worden gebruikt in remblokken voor auto's te stabiliseren..
Isotoop 124Sb wordt samen met beryllium gebruikt als neutronenbron, met een energiegemiddelde van 24 keV. Daarnaast wordt antimoon gebruikt als katalysator bij de productie van kunststoffen..
Risico's
Het is een bros element, dus tijdens het hanteren kan een vervuilend stof uit de omgeving worden geproduceerd. Bij werknemers die zijn blootgesteld aan antimoonstof zijn dermatitis, renitis, ontsteking van de bovenste luchtwegen en conjunctivitis waargenomen.
Pneumoconiose, soms gecombineerd met obstructieve pulmonale veranderingen, is beschreven na langdurige blootstelling.
Antimoontrioxide kan levensbedreigende schade aan de hartfunctie veroorzaken.
Bij mensen die aan dit element zijn blootgesteld, is de aanwezigheid van voorbijgaande pustuleuze huidinfecties waargenomen..
Voortdurende inname van lage doses van dit metaal kan diarree, braken en maagzweren veroorzaken. Evenzo is de maximaal toelaatbare concentratie in lucht 0,5 mg / m3.
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). Mc Graw Hill.
- Veel. (11 maart 2009). Geel antimoon en explosief antimoon. Hersteld van: antimonyproperties.blogspot.com
- Prof. Ernst Cohen en J. C. Van Den Bosch. (1914). De allotropie van antimoon. Proceedings Royal Acad. Amsterdam. Deel XVII.
- Wikipedia. (2019). Antimoon. Hersteld van: en.wikipedia.org
- Advameg, Inc. (2019). Antimoon. Hersteld van: chemistryexplained.com
- Sable Mc'Oneal. (15 september 2018). Chemie: eigenschappen en toepassing van Sb-antimoon. Hersteld van: medium.com



Niemand heeft nog op dit artikel gereageerd.