
Benzylbenzylwaterstofatomen, carbokationen, benzylradicalen
De benzyl of benzyl is een veel voorkomende substituentgroep in de organische chemie waarvan de formule C is6H.5CHtwee- of Bn-. Structureel bestaat het eenvoudigweg uit de vereniging van een methyleengroep, CHtwee, met een fenylgroep, C6H.5dat wil zeggen, een carbon sp3 direct gebonden aan een benzeenring.
Daarom kan de benzylgroep worden gezien als een aromatische ring die aan een kleine ketting is bevestigd. In sommige teksten heeft het gebruik van de afkorting Bn de voorkeur in plaats van C6H.5CHtwee-, gemakkelijk te herkennen zijn in elke verbinding; vooral wanneer gehecht aan een zuurstof- of stikstofatoom, O-Bn of NBntwee, respectievelijk.

Deze groep wordt ook impliciet aangetroffen in een aantal algemeen bekende verbindingen. Bijvoorbeeld voor benzoëzuur, C.6H.5COOH, kan worden beschouwd als een benzyl waarvan de koolstofsp3 het heeft een uitgebreide oxidatie ondergaan; of benzaldehyde, C6H.5CHO, van een gedeeltelijke oxidatie; en benzylalcohol, C6H.5CHtweeOH, nog minder roestig.
Een ander enigszins voor de hand liggend voorbeeld van deze groep is te vinden in tolueen, C6H.5CH3, die een bepaald aantal reacties kunnen ondergaan als gevolg van de ongebruikelijke stabiliteit als gevolg van benzylradicalen of carbokationen. De benzylgroep dient echter om de OH- of NH-groepen te beschermen.twee van reacties die het te synthetiseren product op ongewenste wijze wijzigen.
Artikel index
- 1 Voorbeelden van verbindingen met benzylgroep
- 2 Benzylwaterstofatomen
- 3 Carbocaties en benzylradicalen
- 3.1 Resonantie in de benzylgroep
- 3.2 Andere radicalen
- 4 reacties
- 5 referenties
Voorbeelden van verbindingen met benzylgroep
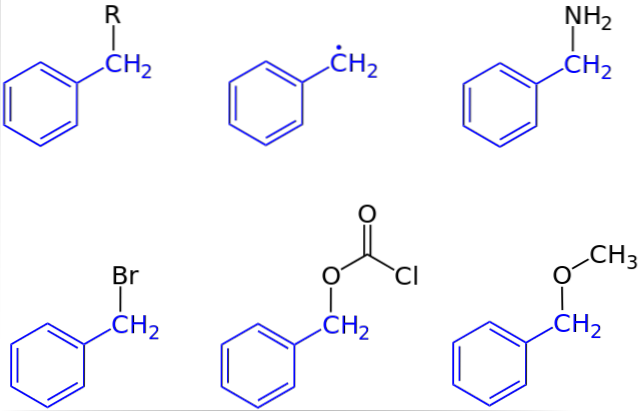
In de eerste afbeelding werd de algemene weergave van een verbinding met een benzylgroep getoond: C6H.5CHtwee-R, waarbij R elk ander moleculair fragment of atoom kan zijn. Door R te variëren kan dus een groot aantal voorbeelden worden verkregen; sommige eenvoudig, andere alleen voor een specifiek gebied van een grotere structuur of set.
Benzylalcohol is bijvoorbeeld afgeleid van het substitueren van R: C door OH6H.5CHtwee-OH. Als het in plaats van OH de NH-groep istwee, dan ontstaat de benzylamineverbinding: C6H.5CHtwee-NHtwee.
Als Br het atoom is dat R vervangt, is de resulterende verbinding benzylbromide: C6H.5CHtwee-Br; R voor COtweeCl geeft aanleiding tot een ester, benzylchloorcarbonaat (of carbobenzoxylchloride); en OCH3 geeft aanleiding tot benzylmethylether, C6H.5CHtwee-OCH3.
Zelfs (hoewel niet helemaal correct), kan R worden aangenomen door een eenzaam elektron: de benzylradicaal, C6H.5CHtwee·, Product van de bevrijding van de radicale R ·. Een ander voorbeeld, hoewel niet opgenomen in de afbeelding, is fenylacetonitril of benzylcyanide, C.6H.5CHtwee-CN.
Er zijn verbindingen waarbij de benzylgroep nauwelijks een specifiek gebied vertegenwoordigt. Wanneer dit het geval is, wordt de afkorting Bn vaak gebruikt om de structuur en de illustraties te vereenvoudigen..
Benzyl waterstofatomen
De bovenstaande verbindingen hebben niet alleen de aromatische of fenylring gemeen, maar ook benzylische waterstofatomen; dit zijn degenen die tot de sp carbon behoren3.
Dergelijke waterstofatomen kunnen worden weergegeven als: Bn-CH3, Bn-CHtweeR of Bn-CHRtwee. De Bn-CR-verbinding3 mist benzylwaterstof, en daarom is de reactiviteit ervan minder dan die van de anderen.
Deze waterstofatomen verschillen van die welke gewoonlijk aan een sp-koolstof worden gehecht3.
Beschouw bijvoorbeeld methaan, CH4, die ook kan worden geschreven als CH3-H. Om de CH-binding te verbreken3-H bij een heterolytische afbraak (radicaalvorming) moet een bepaalde hoeveelheid energie geleverd worden (104kJ / mol).
De energie voor dezelfde C-binding breekt echter6H.5CHtwee-H is lager in vergelijking met methaan (85 kJ / mol). Omdat deze energie minder is, impliceert dit dat de radicale C6H.5CHtweeHet is stabieler dan CH3Hetzelfde gebeurt in meer of mindere mate met andere benzylische waterstofatomen.
Bijgevolg zijn benzylische waterstofatomen reactiever in het genereren van stabielere radicalen of carbokationen dan die welke worden veroorzaakt door andere waterstofatomen. Waarom? De vraag wordt in de volgende sectie beantwoord.
Carbocaties en benzylradicalen
De radicale C werd al overwogen6H.5CHtwee·, Bij gebrek aan de benzylcarbocatie: C6H.5CHtwee+. In het eerste is er een eenzaam ongepaard elektron, en in het tweede een elektronisch defect. De twee soorten zijn zeer reactief en vertegenwoordigen tijdelijke verbindingen waaruit de eindproducten van de reactie afkomstig zijn..
Carbon sp3, na het verliezen van een of twee elektronen om respectievelijk de radicaal of carbocatie te vormen, kan het sp hybridisatie aannementwee (trigonaal vlak), zodanig dat er zo min mogelijk afstoting is tussen de elektronische groepen. Maar als het sptwee, Kan vervoeging plaatsvinden, net als de aromatische ringkoolstofatomen? Het antwoord is ja.
Resonantie in de benzylgroep
Deze conjugatie of resonantie is de sleutelfactor om de stabiliteit van deze benzyl- of benzyl-afgeleide soorten te verklaren. De volgende afbeelding illustreert een dergelijk fenomeen:
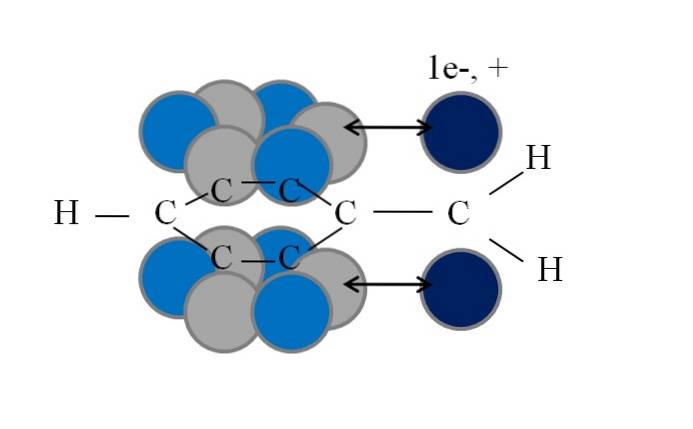
Merk op dat waar een van de benzylische waterstofatomen was, er een orbitaal overbleef p met een ongepaard elektron (radicaal, 1e-), of ongeldig (carbocation, +). Zoals te zien is deze orbitaal p is parallel aan het aromatische systeem (de grijze en lichtblauwe cirkels), waarbij de dubbele pijl het begin van de vervoeging aangeeft.
Dus zowel het ongepaarde elektron als de positieve lading kunnen worden overgedragen of verspreid door de aromatische ring, aangezien het parallellisme van hun orbitalen dit geometrisch begunstigt. Deze liggen echter niet in een orbitaal p aromatische ring; alleen in die welke behoren tot de koolstofatomen in ortho- en paraposities met betrekking tot CHtwee.
Daarom steken de lichtblauwe cirkels uit boven de grijze: daarin is de negatieve of positieve dichtheid van respectievelijk de radicaal of carbokation geconcentreerd..
Andere radicalen
Opgemerkt moet worden dat deze vervoeging of resonantie niet kan voorkomen in sp koolstofatomen3 het verst verwijderd van de aromatische ring.
Bijvoorbeeld de radicale C6H.5CHtweeCHtweeHet is veel onstabieler omdat het ongepaarde elektron niet kan conjugeren met de ring wanneer de CH-groep tussenbeide komttwee tussen en met sp-hybridisatie3. Hetzelfde geldt voor C6H.5CHtweeCHtwee+.
Reacties
Samenvattend: benzylische waterstofatomen zijn geneigd om te reageren, hetzij een radicaal of een carbokation genereren, die op zijn beurt het eindproduct van de reactie veroorzaakt. Daarom reageren ze via een SN-mechanisme.1.
Een voorbeeld is de bromering van tolueen onder ultraviolette straling:
C6H.5CH3 + 1 / 2Brtwee => C6H.5CHtweeBr
C6H.5CHtweeBr + 1/2 Brtwee => C6H.5CHBrtwee
C6H.5CHBrtwee + 1 / 2Brtwee => C6H.5CBr3
In feite worden bij deze reactie Br-radicalen geproduceerd..
Aan de andere kant reageert de benzylgroep zelf om de OH- of NH-groepen te beschermen.twee in een eenvoudige substitutiereactie. Zo kan een ROH-alcohol worden 'gebenzyleerd' met benzylbromide en andere reagentia (KOH of NaH):
ROH + BnBr => ROBn + HBr
ROBn is een benzylether, waarnaar de oorspronkelijke OH-groep kan worden teruggevoerd als deze wordt onderworpen aan een reductief medium. Deze ether moet ongewijzigd blijven terwijl andere reacties op de verbinding worden uitgevoerd..
Referenties
- Morrison, R.T. en Boyd, R. N. (1987). Organische chemie. (5e editie). Addison-Wesley Iberoamericana.
- Carey, F. A. (2008). Organische chemie. (6e editie). McGraw-Hill, Interamerica, Editores S.A.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organische chemie. Amines. (10e editie.). Wiley plus.
- Wikipedia. (2019). Benzylgroep. Hersteld van: en.wikipedia.org
- Dr. Donald L. Robertson. (5 december 2010). Fenyl of benzyl? Hersteld van: home.miracosta.edu
- Gamini Gunawardena. (2015, 12 oktober). Benzylic Carbocation. Chemie LibreTexts. Hersteld van: chem.libretexts.org



Niemand heeft nog op dit artikel gereageerd.