
Formule, eigenschappen en toepassingen van aluminiumbromide
De aluminiumbromide Het is een verbinding die bestaat uit een aluminiumatoom en een gevarieerd aantal broomatomen. Het wordt gevormd afhankelijk van het aantal valentie-elektronen dat aluminium heeft.
Omdat het een verbinding is, verbonden door een metaal (aluminium) en een niet-metaal (broom), worden covalente bindingen gevormd die de structuren een zeer goede stabiliteit geven, maar zonder die van een ionische binding te bereiken..
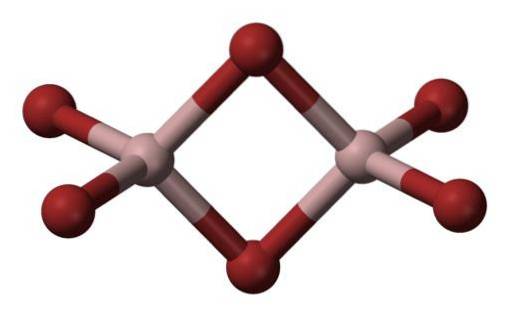
Aluminiumbromide is een stof die normaal gesproken in vaste toestand voorkomt, met een kristallijne structuur.
De kleuren van de verschillende aluminiumbromiden verschijnen als lichtgeel in verschillende tinten en verschijnen soms zonder duidelijke kleur.
De kleur hangt af van het lichtreflectievermogen van de compound en verandert afhankelijk van de structuren die worden gemaakt en de vormen die het aanneemt..
De vaste toestand van deze verbindingen kristalliseert, zodat ze goed gedefinieerde structuren hebben met een uiterlijk dat lijkt op zeezout, maar met verschillende kleuren..
Formule
Aluminiumbromide bestaat uit een aluminiumatoom (Al) en verschillende hoeveelheden broomatomen (Br), afhankelijk van de valentie-elektronen die aluminium heeft..
Om deze reden kan de algemene formule voor aluminiumbromide als volgt worden geschreven: AlBrx, waarbij "x" het aantal broomatomen is dat zich aan aluminium bindt.
De meest voorkomende vorm waarin het voorkomt is als Al2Br6, een molecuul met twee aluminiumatomen als de belangrijkste basis van de structuur..
De bindingen tussen hen worden gevormd door twee broom in het midden, zodat elk aluminiumatoom vier broomatomen in zijn structuur heeft, maar op hun beurt delen ze twee.
Eigendommen
Vanwege zijn aard is het zeer oplosbaar in water, maar het is ook gedeeltelijk oplosbaar in verbindingen zoals methanol en aceton, in tegenstelling tot andere soorten stoffen..
Het heeft een molecuulgewicht van 267 g / mol en wordt gevormd door covalente bindingen.
Natriumbromide bereikt zijn kookpunt bij 255 ° C en bereikt zijn smeltpunt bij 97,5 ° C.
Een ander kenmerk van deze verbinding is dat het gifstoffen afgeeft wanneer het verdampt, dus het wordt niet aanbevolen om ermee te werken bij hoge temperaturen zonder voldoende bescherming en relevante veiligheidskennis..
Toepassingen
Een van de toepassingen die aan dit type stof wordt gegeven vanwege de metallische en niet-metallische aard ervan, zijn middelen in chemische zuiverheidstests..
Zuiverheidstesten zijn erg belangrijk bij het bepalen van de kwaliteit van reagentia en het maken van producten waar mensen tevreden over zijn..
Bij wetenschappelijk onderzoek wordt het op zeer wisselende wijze gebruikt. Om bijvoorbeeld complexe structuren te vormen, middelen bij de synthese van andere waardevolle chemische producten, bij de hydrogenering van dihydroxynaftalenen en bij de selectiviteit bij reacties, naast andere toepassingen..
Deze verbinding is niet commercieel populair. Zoals hierboven te zien is, heeft het een aantal toepassingen die heel specifiek zijn, maar erg interessant voor de wetenschappelijke gemeenschap..
Referenties
- Chang, R. (2010). Chemie (10e ed.) McGraw-Hill Interamericana.
- Krahl, T., & Kemnitz, E. (2004). Amorf aluminiumbromide fluoride (ABF). Angewandte Chemie - Internationale editie, 43(48), 6653-6656. doi: 10.1002 / anie.200460491
- Golounin, A., Sokolenko, V., Tovbis, M., & Zakharova, O. (2007). Complexen van nitronaftolen met aluminiumbromide. Russian Journal of Applied Chemistry, 80(6), 1015-1017. doi: 10.1134 / S107042720706033X
- Koltunov, K. Y. (2008). Condensatie van naftaleendiolen met benzeen in aanwezigheid van aluminiumbromide: een efficiënte synthese van 5-, 6- en 7-hydroxy-4-fenyl-1- en 2-tetralonen. Tetrahedron Letters, 49(24), 3891-3894. doi: 10.1016 / j.tetlet.2008.04.062
- Guo, L., Gao, H., Mayer, P., & Knochel, P. (2010). Bereiding van organoaluminiumreagentia uit propargylbromiden en aluminium geactiveerd door PbCl2 en hun regio- en diastereoselectieve toevoeging aan carbonylderivaten. Chemistry-a European Journal, 16(32), 9829-9834. doi: 10.1002 / chem.201000523
- Ostashevskaya, L. A., Koltunov, K. Y., & Repinskaya, I. B. (2000). Ionische hydrogenering van dihydroxynaftalenen met cyclohexaan in aanwezigheid van aluminiumbromide. Russian Journal of Organic Chemistry, 36(10), 1474-1477.
- Iijima, T., en Yamaguchi, T. (2008). Efficiënte regioselectieve carboxylering van fenol tot salicylzuur met superkritisch CO2 in aanwezigheid van aluminiumbromide. Journal of Molecular Catalysis A: Chemical, 295(1-2), 52-56. doi: 10.1016 / j.molcata.2008.07.017
- Murachev, V. B., Byrikhin, V. S., Nesmelov, A. I., Ezhova, E. A., & Orlinkov, A. V. (1998). 1H NMR spectroscopische studie van het tert-butylchloride-aluminiumbromide kationische initiatiesysteem. Russisch chemisch bulletin, 47(11), 2149-2154.



Niemand heeft nog op dit artikel gereageerd.