
Lithiumbromide structuur, eigenschappen, gebruik, risico's
De lithiumbromide het is een neutraal zout van een alkalimetaal waarvan de chemische formule LiBr is. De formule geeft aan dat de kristallijne vaste stof is samengesteld uit Li-ionen+ en Br- in een verhouding van 1: 1. De kristallen zijn wit of lichtbeige. Het is goed oplosbaar in water en het is ook een redelijk hygroscopisch zout..
Deze laatste eigenschap maakt het gebruik ervan als droogmiddel in airconditioning- en koelsystemen mogelijk. Evenzo werd lithiumbromide sinds het begin van de 20e eeuw gebruikt bij de behandeling van bepaalde psychische stoornissen, waarbij het gebruik ervan werd stopgezet vanwege een ongepast gebruik van zout.
LiBr wordt geproduceerd door lithiumcarbonaat, Li, te behandelentweeCO3, met broomwaterstofzuur. Na verwarming van het medium slaat het als hydraat uit de waterige oplossing neer..
Dit zout irriteert de huid en ogen bij contact, terwijl het bij inademing irritatie van de luchtwegen veroorzaakt. De inname van lithiumzouten kan misselijkheid, braken, diarree en duizeligheid veroorzaken.
Artikel index
- 1 Structuur van lithiumbromide
- 1.1 Hydrateert en glazen
- 2 Eigenschappen
- 2.1 Molecuulgewicht
- 2.2 Uiterlijk
- 2.3 Geur
- 2.4 Smeltpunt
- 2.5 Kookpunt
- 2.6 Oplosbaarheid in water
- 2.7 Oplosbaarheid in organische oplosmiddelen
- 2.8 Brekingsindex (ηD)
- 2.9 Warmtecapaciteit
- 2.10 Standaard molaire entropie (Sθ 298)
- 2.11 Vlampunt
- 2.12 Stabiliteit
- 2.13 Ontleding
- 2,14 pH
- 2.15 Reactiviteit
- 2.16 Productie
- 3 Nomenclatuur
- 4 toepassingen
- 4.1 Droogmiddel
- 4.2 Vezels
- 4.3 Farmaceutische producten
- 4.4 Kalmerend middel
- 5 Risico's
- 5.1 Contacttoxiciteit
- 5.2 Inslikken
- 6 referenties
Structuur van lithiumbromide
De LiBr-formule maakt duidelijk dat de Li / Br-verhouding gelijk is aan 1; voor elke Li cation+ er moet een Br anion zijn- tegenhanger. Daarom moet deze verhouding constant worden gehouden in alle hoeken van het LiBr-kristal..
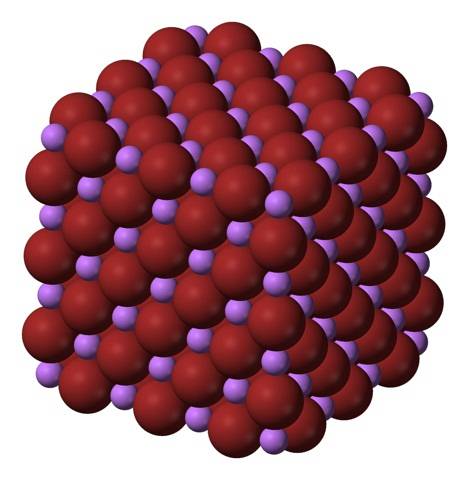
Li-ionen+ en Br- ze trekken elkaar aan, waardoor de afstotingen tussen gelijke ladingen afnemen, om op deze manier een kubisch kristalachtig edelsteenzout te creëren; dit is isomorf met NaCl (bovenste afbeelding). Merk op dat de hele set op zichzelf een kubische geometrie heeft.
In dit kristal is de Li+ ze zijn kleiner en hebben een lichtpaarse kleur; terwijl de Br- ze zijn volumineuzer en donkerbruin van kleur. Opgemerkt wordt dat elk ion zes buren heeft, wat hetzelfde is als zeggen dat ze een octaëdrische coördinatie vertonen: LiBr6 of Li6Br; als de eenheidscel echter wordt beschouwd, blijft de Li / Br-verhouding 1.
Dit is de kristalstructuur die bij voorkeur wordt aangenomen door LiBr. Het kan echter ook andere soorten kristallen vormen: wurziet, als het kristalliseert bij lage temperaturen (-50 ° C) op een substraat; of lichaamsgecentreerd kubisch, of CsCl-type, als het kubieke edelsteenzoutkristal onder hoge druk wordt blootgesteld.
Hydrateert en geeft een bril
Het voorgaande is van toepassing op watervrije LiBr. Dit zout is hygroscopisch en kan daarom vocht uit de omgeving opnemen en watermoleculen inbrengen in zijn eigen kristallen. Zo ontstaan de hydraten LiBrnHtweeO (n = 1, 2, 3 ..., 10). Voor elk hydraat is de kristalstructuur anders.
Kristallografische studies hebben bijvoorbeeld vastgesteld dat LiBrHtweeOf neem een perovskietachtige structuur aan.
Als deze hydraten zich in waterige oplossing bevinden, kunnen ze onderkoelen en verglazen; dat wil zeggen, ze nemen een schijnbaar kristallijne maar moleculair ongeordende structuur aan. Onder dergelijke omstandigheden worden waterstofbruggen in water behoorlijk belangrijk..
Eigendommen
Molecuulgewicht
88,845 g / mol.
Uiterlijk
Witte of lichtbeige kristallijne vaste stof.
Geur
Toilet.
Smeltpunt
552 ºC (1026 ºF, 825 K).
Kookpunt
1.256 ºC (2.309 ºF, 1.538 K).
Oplosbaarheid in water
166,7 g / 100 ml bij 20 ° C. Let op de hoge oplosbaarheid.
Oplosbaarheid in organische oplosmiddelen
Oplosbaar in methanol, ethanol, ether en aceton. Enigszins oplosbaar in pyridine, een aromatische verbinding en minder polair dan de vorige.
Brekingsindex (ηD)
1.784.
Calorische capaciteit
51,88 J / mol K.
Standaard molaire entropie (S.θ 298)
66,9 J / mol K.
ontstekingspunt
1265 ° C. Het wordt als niet-ontvlambaar beschouwd.
Stabiliteit
Stal. De watervrije vorm is echter extreem hygroscopisch.
Ontleding
Wanneer het door verwarming wordt afgebroken, produceert het lithiumoxide.
pH
Tussen pH 6 en 7 in waterige oplossing (100 g / L, 20 ºC).
Reactiviteit
Lithiumbromide is niet reactief onder normale omgevingsomstandigheden. U kunt echter sterke reacties ervaren met sterke zuren naarmate de temperatuur stijgt..
Bij het oplossen in water neemt de temperatuur toe, veroorzaakt door een negatieve hydratatie-enthalpie.
Productie
LiBr wordt geproduceerd door lithiumhydroxide of lithiumcarbonaat te laten reageren met broomwaterstofzuur in een neutralisatiereactie:
LitweeCO3 + HBr => LiBr + COtwee + H.tweeOF
Lithiumbromide wordt verkregen als een hydraat. Om de watervrije vorm te verkrijgen, is het noodzakelijk om het gehydrateerde zout onder vacuüm te verwarmen..
Nomenclatuur
De naam 'lithiumbromide' is afgeleid van het feit dat het een metaalhalogenide is, zo genoemd volgens de voorraadnomenclatuur. Andere namen, even geldig maar minder gebruikt, zijn lithiummonobromide, volgens de systematische nomenclatuur; en lithisch bromide (de unieke valentie van +1 voor lithium), volgens de traditionele nomenclatuur.
Toepassingen
Droogmiddel
LiBr is een hygroscopisch zout dat een geconcentreerde pekel vormt die vocht uit de lucht kan opnemen over een breed temperatuurbereik. Deze pekel wordt gebruikt als droogmiddel in airconditioning- en koelsystemen..
Vezels
Het wordt gebruikt om het volume van wol, haar en andere organische vezels te vergroten.
Farmaceutische adducten
LiBr vormt adducten met sommige farmaceutische verbindingen, waardoor hun werking wordt gemoduleerd. Een adduct is de combinatie door coördinatie van twee of meer moleculen, zonder een structurele verandering van een van de samengevoegde moleculen te veroorzaken.
Kalmerend
Lithiumbromide werd voor het eerst gebruikt als kalmerend middel bij bepaalde psychische stoornissen, en het werd stopgezet in 1940. Momenteel wordt lithiumcarbonaat gebruikt; maar in elk geval is lithium het element dat de therapeutische werking in beide verbindingen uitoefent.
Lithium wordt gebruikt bij de behandeling van een bipolaire stoornis, omdat het nuttig is geweest bij de beheersing van manische episodes van de stoornis. Lithium wordt verondersteld de activiteit van prikkelende neurotransmitters, zoals dopamine en glutaminezuur, te remmen.
Aan de andere kant verhoogt het de activiteit van het remmende systeem dat wordt gemedieerd door de neurotransmitter gamma-aminoboterzuur (GABA). Deze acties zouden deel kunnen uitmaken van de basis van de therapeutische werking van lithium.
Risico's
Contacttoxiciteit
Huidirritatie en sensibilisatie, allergieën. Ernstig oogletsel of irritatie van de ogen, luchtwegen, neusgangen en keel.
Inslikken
De belangrijkste symptomen bij inname van lithiumbromide zijn: gastro-intestinale stoornissen, braken en misselijkheid. Andere nadelige effecten van het innemen van zout zijn opwinding, spasmen en bewustzijnsverlies..
De aandoening die bekend staat als "bromisme" kan optreden bij doses lithiumbromide van meer dan 225 mg / dag..
Sommige van de volgende tekenen en symptomen kunnen optreden bij grappen: verergering van acne en verlies van eetlust, tremoren, spraakproblemen, apathie, zwakte en maniakale agitatie.
Referenties
- Chemische formulering. (2019). Lithiumbromide. Hersteld van: Formulacionquimica.com
- David C. Johnson. (10 juli 2008). Nieuwe bestelling voor lithiumbromide. Natuur. doi.org/10.1038/454174a
- Aayushi Jain & R.C. Dixit. (s.f.). Structurele faseovergang in lithiumbromide: effect van druk en temperatuur. [Pdf]. Hersteld van: ncpcm.in
- Takamuku et al. (1997). Röntgendiffractiestudies op onderkoelde waterige lithiumbromide- en lithiumjodide-oplossingen. Departement Chemie, Faculteit Wetenschappen, Fukuoka University, Nanakuma, Jonan-ku, Fukuoka 814-80, Japan.
- Nationaal centrum voor informatie over biotechnologie. (2019). Lithiumbromide. PubChem-database, CID = 82050. Hersteld van: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2019). Lithiumbromide. Hersteld van: en.wikipedia.org
- Royal Society of Chemistry. (2019). Lithiumbromide. Chemspider. Hersteld van: chemspider.com



Niemand heeft nog op dit artikel gereageerd.