
Buteenkenmerken, chemische structuur en toepassingen
De buteen is de naam die wordt gegeven aan een reeks van vier isomeren met de chemische formule C4H.8. Het zijn alkenen of olefinen, dat wil zeggen dat ze een C = C dubbele binding in hun structuur hebben. Bovendien zijn het koolwaterstoffen, die worden aangetroffen in olievelden of ontstaan door thermisch kraken en die producten met een lager molecuulgewicht verkrijgen..
De vier isomeren reageren met zuurstof, waarbij warmte en een gele vlam vrijkomen. Evenzo kunnen ze reageren met een breed spectrum van kleine moleculen die bijdragen aan hun dubbele binding..
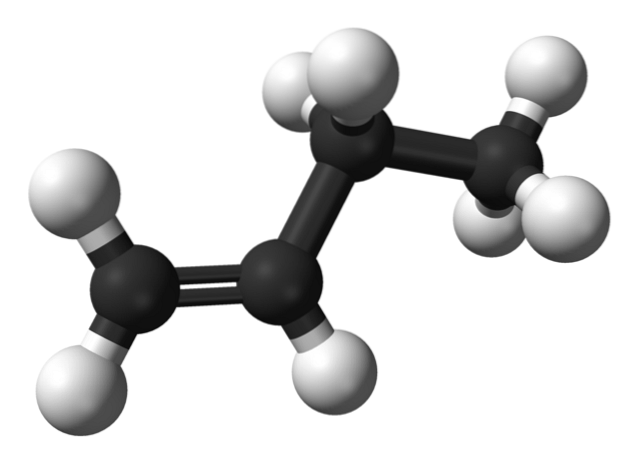
Maar wat zijn de isomeren van buteen? In de bovenste afbeelding wordt de structuur weergegeven met witte (waterstofatomen) en zwarte (koolstofatomen) bollen voor 1-buteen. 1-Buteen is de eenvoudigste isomeer van koolwaterstof C4H.8. Merk op dat er acht witte bollen en vier zwarte bollen zijn, wat overeenkomt met de chemische formule.
De andere drie isomeren zijn cis en trans-2-buteen en iso-buteen. Ze vertonen allemaal zeer vergelijkbare chemische eigenschappen, hoewel hun structuren variaties in fysische eigenschappen veroorzaken (smelt- en kookpunten, dichtheden, enz.). Ook hebben hun IR-spectra vergelijkbare patronen van absorptiebanden..
In de volksmond wordt 1-buteen buteen genoemd, hoewel 1-buteen alleen verwijst naar een enkele isomeer en niet naar een generieke naam. Deze vier organische verbindingen zijn gassen, maar ze kunnen bij hoge druk vloeibaar worden of condenseren (en zelfs kristalliseren) bij temperatuurdaling..
Ze zijn een bron van warmte en energie, reagentia voor de synthese van andere organische verbindingen en vooral nodig voor de vervaardiging van kunstrubber na de synthese van butadieen..
Artikel index
- 1 Kenmerken van buteen
- 1.1 Molecuulgewicht
- 1.2 Fysieke aspecten
- 1.3 Kookpunt
- 1.4 Smeltpunt
- 1.5 Oplosbaarheid
- 1.6 Dichtheid
- 1.7 Reactiviteit
- 2 Chemische structuur
- 2.1 Constitutionele en geometrische isomeren
- 2.2 Stabiliteit
- 2.3 Intermoleculaire krachten
- 3 toepassingen
- 4 referenties
Buteen kenmerken
Molecuulgewicht
56,106 g / mol. Dit gewicht is hetzelfde voor alle isomeren met formule C.4H.8.
Fysieke aspecten
Het is een kleurloos en brandbaar gas (net als de andere isomeren) en heeft een relatief aromatische geur..
Kookpunt
De kookpunten van de isomeren van buteen zijn als volgt:
1-Buteen: -6ºC
Cis-2-Buteen: 3,7 ° C
Trans-2-buteen: 0,96 ° C
2-methylpropeen: -6,9ºC
Smeltpunt
1-Buteen: -185,3 ° C
Cis-2-Buteen: -138,9 ° C
Trans-2-buteen: -105,5 ° C
2-methylpropeen: -140,4 ° C
Oplosbaarheid
Buteen is vanwege zijn niet-polaire aard zeer onoplosbaar in water. Het lost echter perfect op in sommige alcoholen, benzeen, tolueen en ethers..
Dichtheid
0,577 bij 25 ° C. Daarom is het minder dicht dan water en zou het zich in een container erboven bevinden..
Reactiviteit
Zoals elk alkeen is zijn dubbele binding gevoelig voor het toevoegen van moleculen of oxidatie. Dit maakt buteen en zijn isomeren reactief. Aan de andere kant zijn het brandbare stoffen, dus bij oververhitting reageren ze met de zuurstof in de lucht..
Chemische structuur
In de bovenste afbeelding is de structuur van 1-buteen weergegeven. Links daarvan zie je de locatie van de dubbele binding tussen de eerste en tweede koolstof. Het molecuul heeft een lineaire structuur, hoewel het gebied rond de C = C-binding vlak is vanwege sp-hybridisatietwee van deze koolstofatomen.
Als het 1-buteenmolecuul onder een hoek van 180 ° zou worden geroteerd, zou het hetzelfde molecuul hebben zonder duidelijke veranderingen, daarom mist het optische activiteit.
Hoe zouden de moleculen op elkaar inwerken? De C-H-, C = C- en C-C-bindingen zijn apolair van aard, dus geen van hen werkt samen bij de vorming van een dipoolmoment. Bijgevolg zijn de moleculen CHtwee= CHCHtweeCH3 moet op elkaar inwerken door middel van Londense dispersiekrachten.
Het rechteruiteinde van buteen vormt instantane dipolen, die op korte afstand aangrenzende atomen van een naburig molecuul polariseren. Van zijn kant werkt het linkeruiteinde van de C = C-binding samen door de π-wolken op elkaar te plaatsen (zoals twee wafels of vellen).
Omdat het moleculaire skelet uit vier koolstofatomen bestaat, zijn hun interacties nauwelijks genoeg om de vloeistoffase een kookpunt van -6ºC te laten hebben..
Constitutionele en geometrische isomeren
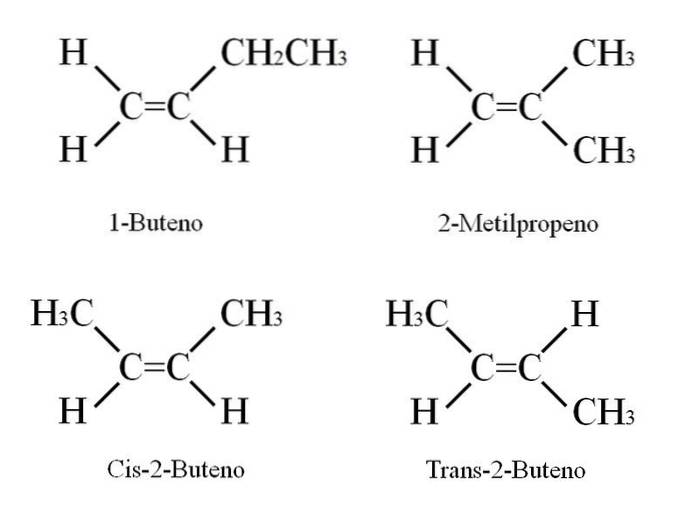
1-Buteen heeft de molecuulformule C4H.8Andere verbindingen kunnen echter dezelfde hoeveelheid C- en H-atomen in hun structuur hebben..
Hoe is het mogelijk? Als de structuur van 1-buteen nauwlettend in de gaten wordt gehouden, kunnen de substituenten op de C = C-koolstofatomen worden uitgewisseld. Deze uitwisseling produceert andere verbindingen uit hetzelfde skelet. Bovendien kan de positie van de dubbele binding tussen C-1 en C-2 verschuiven naar C-2 en C-3: CH3CH = CHCH3, 2-Buteen.
In 2-buteen kunnen de H-atomen zich aan dezelfde kant van de dubbele binding bevinden, wat overeenkomt met het cis-stereo-isomeer; of in een tegengestelde ruimtelijke oriëntatie, in het trans-stereo-isomeer. Beide vormen wat ook wel geometrische isomeren worden genoemd. Hetzelfde geldt voor -CH-groepen3.
Merk ook op dat als het in het CH-molecuul achterbleef3CH = CHCH3 de H-atomen aan de ene kant en de CH-groepen3 in een andere zou een constitutioneel isomeer worden verkregen: CHtwee= C (CH3twee, 2-methylpropeen (ook bekend als isobuteen).
Deze vier verbindingen hebben dezelfde formule C.4H.8 maar verschillende structuren. 1-buteen en 2-methylpropeen zijn constitutionele isomeren; en cis en trans-2-buteen, geometrische isomeren tussen hen twee (en constitutioneel met betrekking tot de rest).
Stabiliteit
Verbrandingswarmte
Uit de bovenstaande afbeelding, welke van de vier isomeren vertegenwoordigt de meest stabiele structuur? Het antwoord is bijvoorbeeld te vinden in de verbrandingswarmte van elk van hen. Door te reageren met zuurstof, wordt het isomeer met formule C4H.8 verandert in COtwee water en warmte afgeven:
C4H.8(g) + 60twee(g) => 4COtwee(g) + 4HtweeO (g)
Verbranding is exotherm, dus hoe meer warmte er vrijkomt, hoe instabieler de koolwaterstof. Daarom zal een van de vier isomeren die de minste warmte afgeeft bij verbranding in lucht het meest stabiel zijn..
De verbrandingswarmten voor de vier isomeren zijn:
-1-Buteen: 2717 kJ / mol
-cis-2-buteen: 2710 kJ / mol
-trans-2-buteen: 2707 kJ / mol
-2-methylpropeen: 2700 kJ / mol
Merk op dat 2-methylpropeen het isomeer is dat de minste warmte afgeeft. Terwijl 1-buteen degene is die meer warmte afgeeft, wat zich vertaalt in grotere instabiliteit.
Sterisch en elektronisch effect
Dit verschil in stabiliteit tussen de isomeren is direct af te leiden uit de chemische structuur. Volgens de alkenen krijgt degene met meer R-substituenten een grotere stabilisatie van zijn dubbele binding. 1-Buteen is dus het meest onstabiel omdat het nauwelijks een substituent (-CHtweeCH3dat wil zeggen, het is monogesubstitueerd (RHC = CHtwee.
De cis- en trans-isomeren van 2-buteen verschillen in energie vanwege de Van der Wall-spanning die wordt veroorzaakt door het sterische effect. In het cis-isomeer, de twee CH-groepen3 aan dezelfde kant van de dubbele binding stoten ze elkaar af, terwijl ze in de trans-isomeer ver genoeg van elkaar verwijderd zijn.
Maar waarom is 2-methylpropeen dan de meest stabiele isomeer? Omdat het elektronische effect tussenbeide komt.
In dit geval, ook al is het een tweevoudig gesubstitueerd alkeen, de twee CH-groepen3 ze zitten op dezelfde koolstof; in geminale positie ten opzichte van elkaar. Deze groepen stabiliseren het koolstofatoom van de dubbele binding, waardoor het een deel van zijn elektronenwolk wordt (aangezien het relatief zuur is vanwege sp-hybridisatie).twee.
Bovendien hebben de twee isomeren in 2-buteen slechts 2 ° koolstofatomen; terwijl 2-methylpropeen een derde koolstof bevat, met grotere elektronische stabiliteit.
Intermoleculaire krachten
De stabiliteit van de vier isomeren volgt een logische volgorde, maar de intermoleculaire krachten niet. Als hun smelt- en kookpunt worden vergeleken, zal blijken dat ze niet dezelfde volgorde gehoorzamen.
Het zou worden verwacht dat trans-2-buteen de hoogste intermoleculaire krachten zou vertonen vanwege het grotere oppervlaktecontact tussen twee moleculen, in tegenstelling tot cis-2-buteen, waarvan het skelet een C. trekt. Cis-2-buteen kookt echter bij hogere temperatuur (3,7 ° C), dan de trans-isomeer (0,96 ° C).
Vergelijkbare kookpunten voor 1-buteen en 2-methylpropeen zouden worden verwacht omdat ze structureel sterk op elkaar lijken. In de vaste toestand verandert het verschil echter radicaal. 1-Buteen smelt bij -185,3 ° C, terwijl 2-methylpropeen bij -140,4 ° C.
Bovendien smelt het cis-2-buteen-isomeer bij -138,9 ºC, bij een temperatuur die zeer dicht bij 2-methylpropenom ligt, wat kan betekenen dat ze in de vaste stof een even stabiele samenstelling vertonen..
Uit deze gegevens kan worden geconcludeerd dat, ondanks dat ze de meest stabiele structuren kennen, ze onvoldoende licht werpen op de kennis van hoe intermoleculaire krachten in de vloeistof werken; en zelfs meer, in de vaste fase van deze isomeren.
Toepassingen
-Butenen kunnen, gezien hun verbrandingswarmte, gewoon worden gebruikt als warmtebron of als brandstof. Er wordt dus verwacht dat de 1-buteenvlam meer opwarmt dan die van de andere isomeren..
-Kan worden gebruikt als organische oplosmiddelen.
-Ze dienen als additieven om het octaangehalte van benzine te verhogen.
-Binnen de organische synthese neemt 1-buteen deel aan de productie van andere verbindingen zoals: butyleenoxide, 2-glutanol, succinimide en tert-butylmecaptaan (gebruikt om kookgas zijn karakteristieke geur te geven). Evenzo butadieen (CHtwee= CH-CH = CHtwee), waaruit kunstrubber wordt gesynthetiseerd.
Naast deze syntheses hangt de diversiteit van de producten af van welke moleculen aan de dubbele binding worden toegevoegd. Zo kunnen bijvoorbeeld alkylhalogeniden worden gesynthetiseerd als ze reageren met halogenen; alcoholen, als ze water toevoegen in een zuur medium; en tert-butylesters als ze alcoholen met een laag molecuulgewicht (zoals methanol) toevoegen.
Referenties
- Francis A. Carey. Organische chemie. Carbonzuren. (zesde ed., pagina's 863-866). Mc Graw Hill.
- Wikipedia. (2018). Buteen Ontleend aan: es.wikipedia.org
- YPF. (Juli 2017). Buten ons. [Pdf]. Genomen van: ypf.com
- William Reusch. (5 mei 2013). Toevoegingsreacties van alkenen. Hersteld van: 2. chemistry.msu.edu
- PubChem. (2018). 1-Buteen. Hersteld van: pubchem.ncbi.nlm.nih.gov



Niemand heeft nog op dit artikel gereageerd.