
Kenmerken van zuren en basen

De kenmerken van zuren en basen zijn al die eigenschappen en kwaliteiten waarmee we onderscheid kunnen maken tussen een zuur en een base..
Volgens de theorie van Arrehnius, a zuur is een stof die protonen H afgeeft+ wanneer opgelost in water, en een baseren is elke stof die hydroxylionen OH afgeeft- wanneer in waterige oplossing.
| Zuren | Basissen | |
|---|---|---|
| Ionenvorming | Cadeau | Cadeau |
| Neutralisatie-reactie | Als je reageert met een basis. | Als het reageert met een zuur. |
| Oplosbaarheid in water | Oplosbaar | Gedeeltelijk oplosbaar. Calcium-, barium- en aluminiumhydroxiden zijn slecht oplosbaar. |
| Elektrische geleidbaarheid | Cadeau | Cadeau |
| Staat van de zaak | Vast, vloeibaar of gasvormig | Vast, vloeibaar of gasvormig |
| Reactie met lakmoespapier | Rode kleurstof | Blauwe kleurstof |
| PH waarde | Onder 7 | Groter dan 7 |
| Geconjugeerde tegenhanger | Een zwak zuur vormt een geconjugeerde base. | Een zwakke base vormt een geconjugeerd zuur. |
| Corrosief effect | Sterke zuren | Sterke bases |
Kenmerken van zuren
Zuren hebben verschillende kenmerken waarmee ze kunnen worden geïdentificeerd.
Vermogen om ionen te vormen uit zuren
Het belangrijkste kenmerk van zure stoffen is dat ze kunnen worden geïoniseerd, dat wil zeggen dat ze elektronen verliezen of winnen.
Zoutzuur HCl, een sterk zuur, ioniseert om chloride-anion Cl te vormen- en proton H+.
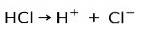
Neutralisatie-reactie
Een zuur reageert met een base om een zout en water te vormen. Deze reactie staat bekend als neutralisatie-reactie. HCl reageert bijvoorbeeld met NaOH om natriumchloride NaCl (keukenzout) en water te vormen:
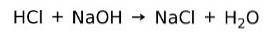
Oplosbaarheid van zuren in water
Zuren zijn over het algemeen oplosbaar in water. Zoutzuur of zoutzuur is bijvoorbeeld matig oplosbaar in water, tot 82 g HCl kan worden opgelost in 100 ml water van 0 ° C. In het geval van zwavelzuur HtweeSW4, mengen met water genereert warmte, dus het is altijd raadzaam om het zuur aan het water toe te voegen om explosies te voorkomen.
Zure sterkte
Hoe zuren dissociëren, bepaalt of ze sterk of zwak zijn. De sterkte van een zuur wordt bepaald door zijn dissociatieconstante.
Salpeterzuur HNO3 het is een sterk zuur omdat het in waterige oplossing volledig ioniseert in protonen en nitraationen:
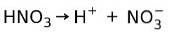
Dit betekent dat wanneer we HNO toevoegen3 in water zullen we bij het analyseren van het water alleen H vinden+ en nitraationen, en vrijwel geen HNO3.
In plaats daarvan is het azijnzuur dat in azijn wordt aangetroffen een zwak zuur, omdat slechts een deel ervan gedissocieerd is:
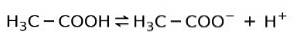
Daarom wordt het weergegeven met pijlen in twee richtingen, dit betekent dat we in waterige oplossing azijnzuur zullen hebben, H+ en het acetaatanion (H3C-COO-.
Toestanden van zuren
Zuren kunnen worden aangetroffen in vloeibare, vaste of gasvormige toestand. Zoutzuur HCl is bijvoorbeeld vloeibaar, waterstofsulfide HS is een gas en oxaalzuur is een vaste stof..
Reactie met lakmoespapier van zuren

Als we een strook lakmoespapier in een zure substantie leggen, kleurt het lakmoespapier rood.
Identificatie van zuren door hun pH
PH is de maat voor de hoeveelheid H+ aanwezig in een oplossing. Dus tussen pH 0 en 7 bevinden we ons in de aanwezigheid van een zuur. Azijn heeft bijvoorbeeld een pH gelijk aan 2, de pH van zwavelzuur in autoaccu's is gelijk aan 1.
Elektrische geleidbaarheid van zuren
Omdat zuren kunnen dissociëren en elektrisch geladen ionen kunnen produceren, kunnen zure oplossingen elektriciteit geleiden. In autoaccu's wordt bijvoorbeeld zwavelzuur gebruikt, een sterk zuur als geleider van elektriciteit..
Corrosief effect van sterke zuren
Sterke zuren hebben een corrosief effect, ze kunnen organische weefsels verbranden, dus er moet uiterst voorzichtig mee worden omgegaan.
Zwakke zuren vormen een geconjugeerde tegenhanger
Zwakke zuren vormen, wanneer opgelost, een zogenaamd geconjugeerd paar, dat wil zeggen, een zwak zuur vormt een geconjugeerde base.
Bijvoorbeeld:
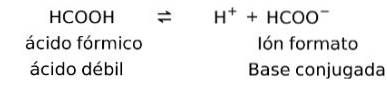
In dit geval vormt mierenzuur of methaanzuur (HCOOH), indien gedissocieerd, het geconjugeerde base-ionenformaat.
Het kan u interesseren:
- Sterke en zwakke zuren en basen.
- Voorbeelden van zuren en basen.
Kenmerken van de bases
Vervolgens presenteren we de eigenschappen van de basen of alkalische oplossingen die ze kenmerken.
Base ionisatie capaciteit
Basische of alkalische stoffen worden gekenmerkt door de vorming van ionen wanneer ze worden opgelost in water:
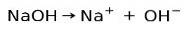
In dit geval ioniseert het natriumhydroxide NaOH om een hydroxide-anion OH te vormen- en een natriumkation Na+.
Een base reageert met een zuur om een zout te vormen
Een base reageert met een zuur in een neutralisatiereactie om water en een zout te vormen, bijvoorbeeld:
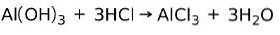
In dit geval is het aluminiumhydroxide Al (OH)3, een base, reageert met HCl en vormt het aluminiumchloridezout AlCl3 en water. Aluminiumhydroxide wordt gebruikt als antacidum om maagreflux te verlichten door het zuur dat door de maag wordt geproduceerd te neutraliseren.
Baseert oplosbaarheid in water
Sommige basen zijn oplosbaar in water. Aardalkalimetaalhydroxiden, zoals calciumhydroxide en bariumhydroxide, zijn slecht oplosbaar in water. Natriumhydroxide of natronloog kan bijvoorbeeld 109 g worden opgelost in 100 ml water van 20 ° C. Terwijl magnesiumhydroxide of melk van magnesiumoxide Mg (OH)twee is praktisch onoplosbaar in water.
Basissterkte
Afhankelijk van de ionisatiegraad van de base kunnen deze sterk of zwak zijn. Lithiumhydroxide is bijvoorbeeld een sterke basis omdat het in waterige oplossing volledig ioniseert in hydroxide-ionen OH en lithium-Li-kationen+
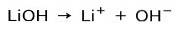
Aan de andere kant, ammoniak NH3 is een zwakke basis want als het in contact komt met water, valt niet alle ammoniak uiteen:
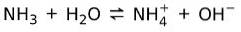
Basistoestand van materie
Basen zijn te vinden in vaste, vloeibare en gasvormige toestanden. Zuiver natriumhydroxide is bijvoorbeeld vast, ammoniak is een gas.
Reactie met het lakmoespapier van de bases
Wanneer we een strook lakmoespapier in een alkalische stof plaatsen, wordt het papier blauw.
Identificatie van basen door hun pH
De basen worden gekenmerkt door een pH tussen 7 en 14.
 Elektrische geleidbaarheid van de bases
Elektrische geleidbaarheid van de bases
De bases vanwege hun ionisatiecapaciteit zijn goede geleiders van elektriciteit. In alkalinebatterijen wordt kaliumhydroxide KOH bijvoorbeeld gebruikt als elektrische geleider..
Bijtende werking van basen
Sterke basen kunnen organische weefsels beschadigen. Keukenovenreinigers zijn bijvoorbeeld over het algemeen sterke bases en het wordt altijd aanbevolen om ze met uiterste zorg te behandelen, met handschoenen en oogbescherming..
Zwakke basen vormen een geconjugeerde tegenhanger
De zwakke basen vormen, wanneer ze zijn opgelost, een geconjugeerde tegenhanger, dat wil zeggen, een zwakke base vormt een geconjugeerd zuur.
Bijvoorbeeld tris- (hydroxymethyl) aminomethaan (OHCHtwee3CNHtwee is een zwakke base waarvan het geconjugeerde zuur (OHCHtwee3CNH3+
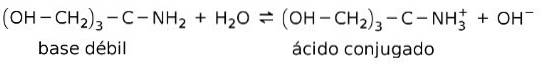
Dit is de basis van de werking van bufferstoffen of buffer, dit zijn stoffen die worden gebruikt om de pH van oplossingen constant te houden.
Misschien ben je geïnteresseerd in de verschillen tussen zuren en basen.


Niemand heeft nog op dit artikel gereageerd.