
Kaliumcyanide (KCN) eigenschappen, toepassingen, structuren, risico's,
De kaliumcyanide is een anorganische verbinding die wordt gevormd door een kalium-K-ion+ en een cyanide-ion CN-. De chemische formule is KCN. Het is een witte kristallijne vaste stof, buitengewoon giftig.
KCN is zeer oplosbaar in water en wanneer het wordt opgelost, hydrolyseert het onder vorming van blauwzuur of HCN-waterstofcyanide, dat ook erg giftig is. Kaliumcyanide kan samengestelde zouten vormen met goud en zilver, daarom werd het vroeger gebruikt om deze edelmetalen uit bepaalde mineralen te extraheren..

KCN wordt gebruikt om goedkope metalen te coaten met goud en zilver via een elektrochemisch proces, dat wil zeggen een methode waarbij een elektrische stroom wordt geleid door een oplossing die een zout bevat dat bestaat uit het edelmetaal, cyanide en kalium..
Omdat kaliumcyanide cyanide bevat, moet het met de grootste zorg worden gehanteerd met geschikte werktuigen. Het mag nooit in het milieu terechtkomen, omdat het ook zeer giftig is voor de meeste dieren en planten..
Er worden echter methoden bestudeerd waarbij gewone algen worden gebruikt om kaliumcyanide te verwijderen uit water dat is verontreinigd met lage concentraties kaliumcyanide..
Artikel index
- 1 Structuur
- 2 Nomenclatuur
- 3 Eigenschappen
- 3.1 Fysieke toestand
- 3.2 Molecuulgewicht
- 3.3 Smeltpunt
- 3.4 Kookpunt
- 3.5 Dichtheid
- 3.6 Oplosbaarheid
- 3,7 pH
- 3.8 Hydrolyseconstante
- 3.9 Chemische eigenschappen
- 3.10 Overige eigenschappen
- 4 Verkrijgen
- 5 Gebruik bij het galvaniseren van metalen
- 5.1 Zilver
- 5.2 Goud
- 5.3 Andere toepassingen
- 6 Risico's
- 7 Werkingsmechanisme
- 7.1 Bijkomende risico's
- 8 Recente onderzoeken
- 9 referenties
Structuur
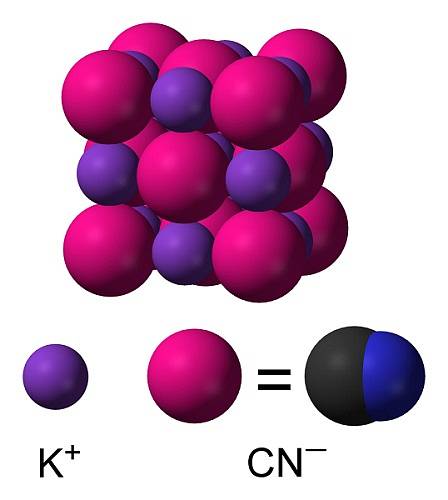
KCN is een ionische verbinding gevormd door een kalium K-kation+ en een cyanide-anion CN-. Hierin is het koolstofatoom verbonden met het stikstofatoom door een drievoudige covalente binding..

In vast kaliumcyanide het CN-anion- Het kan vrij roteren, zodat het zich gedraagt als een bolvormig anion, met als gevolg dat het KCN-kristal een kubische structuur heeft die lijkt op die van kaliumchloride KCl.
Nomenclatuur
- Kaliumcyanide
- Kaliumcyanide
- Cyanokalium
Eigendommen
Fysieke toestand
Witte kristallijne vaste stof. Kubieke kristallen.
Molecuulgewicht
65,116 g / mol.
Smeltpunt
634,5 ° C
Kookpunt
1625 ° C.
Dichtheid
1,55 g / cm3 bij 20 ° C.
Oplosbaarheid
Zeer oplosbaar in water: 716 g / L bij 25 ° C en 100 g / 100 ml water bij 80 ° C. Enigszins oplosbaar in methanol: 4,91 g / 100 g methanol bij 19,5 ° C. Zeer slecht oplosbaar in ethanol: 0,57 g / 100 g ethanol bij 19,5 ° C.
pH
Een waterige oplossing van 6,5 g KCN in 1 L water heeft een pH van 11,0.
Hydrolyse constant
KCN is zeer oplosbaar in water. Als het oplost, is het cyanide-ion CN vrij- waarvoor een proton H nodig is+ van water om blauwzuur HCN te vormen en een OH-ion vrij te geven-
CN- + H.tweeO → HCN + OH-
De hydrolyseconstante geeft de neiging aan waarmee deze reactie wordt uitgevoerd.
Kh = 2,54 x 10-5
Waterige KCN-oplossingen geven HCN-waterstofcyanide af aan het milieu bij verhitting boven 80 ° C.
Chemische eigenschappen
Het is niet brandbaar, maar wanneer vast KCN wordt verhit tot ontbinding, worden zeer giftige gassen uitgestoten, zoals waterstofcyanide HCN, stikstofoxiden NOX, kaliumoxide KtweeO en koolmonoxide CO.
KCN reageert met goudzouten om kaliumaurocyanide KAu (CN) te vormentwee en kaliumatrium KAu (CN)4. Dit zijn kleurloze complexe zouten. Met het zilvermetaal Ag vormt KCN het kaliumargentocyanide KAg (CN)twee.
Het cyanide-ion van KCN reageert met bepaalde organische verbindingen die halogenen bevatten (zoals chloor of broom) en neemt hun plaats in. Het reageert bijvoorbeeld met broomazijnzuur om cyaanazijnzuur te geven..
Andere eigenschappen
Het is hygroscopisch, absorbeert vocht uit de omgeving.
Het heeft een milde, bittere amandelgeur, maar dit wordt niet door alle mensen opgemerkt.
Het verkrijgen van
KCN wordt bereid door kaliumhydroxide KOH in waterige oplossing te laten reageren met waterstofcyanide HCN. Het wordt ook verkregen door kaliumferrocyanide K te verhitten4Geloof (CN)6
K4Geloof (CN)6 → 4 KCN + 2 C + Ntwee↑ + Geloof
Gebruik bij het galvaniseren van metalen
Het wordt gebruikt bij het coaten van laagwaardige metalen met goud en zilver. Het is een elektrolytisch proces, dat wil zeggen dat elektriciteit door een waterige oplossing met geschikte zouten wordt geleid.
Zilver
Kaliumargentocyanide KAg (CN) wordt gebruikttwee voor zilvercoating (Ag) goedkopere metalen.
Deze worden in een waterige oplossing van kaliumargentocyanide KAg (CN) geplaatsttwee, waarbij de anode of positieve pool een staaf puur zilver (Ag) is en de kathode of negatieve pool het goedkope metaal is dat je met zilver wilt coaten.
Terwijl een elektrische stroom door de oplossing gaat, zet het zilver zich af op het andere metaal. Bij gebruik van cyanidezouten wordt de zilverlaag fijner, compacter en hechter afgezet dan in oplossingen van andere verbindingen..

Goud
Evenzo in het geval van goud (Au), kaliumaurocyanide KAu (CN)twee en kaliumatrium KAu (CN)4 worden gebruikt om andere metalen elektrolytisch te vergulden.

Andere gebruiken
Hier zijn enkele andere toepassingen van kaliumcyanide.
- Voor het industriële proces van verharding van staal door nitreren (toevoeging van stikstof).
- Voor metaalreiniging.
- In print- en fotografieprocessen.
- Vroeger werd het gebruikt voor de extractie van goud en zilver uit de mineralen die ze bevatten, maar later werd het vervangen door natriumcyanide NaCN, dat minder duur is, hoewel even giftig..
- Als insecticide voor het besproeien van bomen, schepen, treinwagons en magazijnen.
- Als reagens in analytische chemie, dat wil zeggen om chemische analyses uit te voeren.
- Om andere chemische verbindingen te bereiden, zoals kleurstoffen en kleurstoffen.

Risico's
KCN is een zeer giftige stof voor dieren en de meeste planten en micro-organismen. Het is geclassificeerd als supergiftig. Het is zelfs in zeer kleine hoeveelheden dodelijk.
Het schadelijke effect kan optreden bij inademing, contact met de huid of ogen, of inslikken. Remt veel metabolische processen, vooral bloedeiwitten die betrokken zijn bij zuurstoftransport, zoals hemoglobine.
Het beïnvloedt de organen of systemen die het meest gevoelig zijn voor zuurstofgebrek, zoals het centrale zenuwstelsel (hersenen), het cardiovasculaire systeem (hart en bloedvaten) en de longen.

Werkingsmechanisme
KCN verstoort het vermogen van het lichaam om zuurstof te gebruiken.
Het cyanide-ion CN- KCN heeft een hoge affiniteit voor het ferri-ion Fe3+, wat betekent dat wanneer cyanide wordt opgenomen, het snel reageert met Fe3+ van bloed en weefsels.
Op deze manier voorkomt het dat de cellen ademen, die in een toestand van zuurstofgebrek komen, omdat ze, hoewel ze proberen te ademen, het niet kunnen gebruiken..
Dan is er een voorbijgaande toestand van hyperapneu (ademstilstand) en hoofdpijn, en ten slotte de dood als gevolg van ademstilstand..
Bijkomende risico's
Bij verhitting produceert het zeer giftige gassen zoals HCN, stikstofoxiden NOX, kaliumoxide KtweeO en koolmonoxide CO.
Als het in contact komt met vocht, komt HCN vrij dat licht ontvlambaar en zeer giftig is..
KCN is ook erg giftig voor in het water levende organismen. Het mag nooit in het milieu worden geloosd, aangezien verontreiniging van het water waarin dieren drinken en vissen kunnen voorkomen, kan voorkomen.
Er zijn echter bacteriën die cyanide produceren, zoals Chromobacterium violaceum en sommige soorten Pseudomonas.
Recent onderzoek
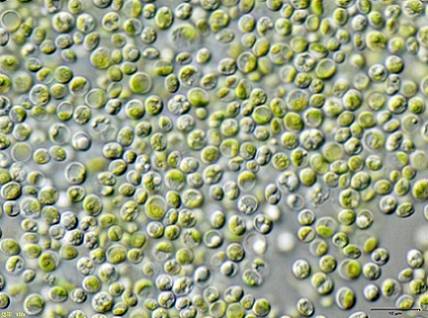
Bepaalde onderzoekers ontdekten dat groene algen Chlorella vulgaris kan worden gebruikt voor de behandeling van water dat is verontreinigd met KCN-kaliumcyanide in lage concentraties.
De algen waren in staat om het KCN efficiënt te verwijderen, aangezien dit in kleine hoeveelheden de groei van de algen stimuleerde omdat het een intern mechanisme activeerde om de toxiciteit van het KCN te weerstaan..
Dit betekent dat de alg Chlorella vulgaris heeft het potentieel om cyanide te verwijderen en dat hiermee een effectieve methode voor de biologische behandeling van cyanideverontreiniging kan worden ontworpen.
Referenties
- ONS. Nationale bibliotheek van geneeskunde. (2019). Kaliumcyanide. Nationaal centrum voor informatie over biotechnologie. Opgehaald van pubchem.ncbi.nlm.nih.gov.
- Coppock, R.W. (2009). Bedreigingen voor wilde dieren door agenten voor chemische oorlogsvoering. In Handbook of Toxicology of Chemical Warfare Agents. Opgehaald van sciencedirect.com.
- Liu, Q. (2017). Evaluatie van de verwijdering van kaliumcyanide en de toxiciteit ervan in groene algen (Chlorella vulgarisBull Environ Contam Toxicol. 2018; 100 (2): 228-233. Opgehaald van ncbi.nlm.nih.gov.
- Het National Institute for Occupational Safety and Health (NIOSH). (2011). Kaliumcyanide: systemisch middel. Hersteld van cdc.gov.
- Alvarado, L.J. et al. (2014). Riboswitch Discovery, structuur en functie. Synthese van Uracil. In Methods in Enzymology. Opgehaald van sciencedirect.com.


Niemand heeft nog op dit artikel gereageerd.