
Natriumcyanide (NaCN) structuur, eigenschappen, risico's, gebruik

De Natriumcyanide is een anorganisch zout gevormd door een natriumkation Na+ en een cyanide-anion CN-. De chemische formule is NaCN. Ook bekend als natriumcyanide, is het een witte kristallijne vaste stof. Het is hygroscopisch, dat wil zeggen, het absorbeert water uit de omgeving en de kristallen zijn kubisch zoals natriumchloride NaCl.
Wanneer het in water wordt opgelost, heeft het de neiging om waterstofcyanide HCN te vormen. Zijn oplossingen lossen gemakkelijk goud en zilver op. Deze eigenschap zorgt ervoor dat het wordt gebruikt om goud en zilver uit zijn mineralen te halen. De oplossingen die hiervoor worden gebruikt, worden gerecycled, dat wil zeggen dat ze meerdere keren worden hergebruikt.

Een deel van de cyanide slaagt er echter in om naar bepaalde afvalvijvers te ontsnappen, wat een gevaar vormt voor dieren in het wild en voor mensen, aangezien cyanide zeer giftig is en de dood kan veroorzaken..
NaCN wordt in de chemische industrie gebruikt als tussenproduct om verschillende soorten verbindingen te bereiden, zoals kleurstoffen, landbouwchemicaliën en medicijnen of medicijnen..
Natriumcyanide is een zeer gevaarlijke verbinding omdat het de dood kan veroorzaken, dus er moet uiterst voorzichtig mee worden omgegaan.
Artikel index
- 1 Structuur
- 2 Nomenclatuur
- 3 Eigenschappen
- 3.1 Fysieke toestand
- 3.2 Molecuulgewicht
- 3.3 Smeltpunt
- 3.4 Kookpunt
- 3.5 Vlampunt
- 3.6 Dichtheid
- 3.7 Oplosbaarheid
- 3.8 Dissociatieconstante
- 3,9 pH
- 3.10 Chemische eigenschappen
- 4 Risico's
- 5 Verkrijgen
- 6 toepassingen
- 6.1 Bij de winning van goud- en zilvermineralen. Gevolgen
- 6.2 Bij de productie van andere chemische verbindingen
- 6.3 In de metaalindustrie
- 6.4 Bij ander gebruik
- 6.5 Niet meer gebruikte, betwiste of zeer zeldzame toepassingen
- 7 referenties
Structuur
Natriumcyanide bestaat uit een Na + -ion en een CN-ion-.
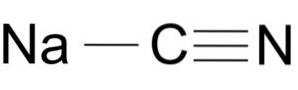
Het cyanide-ion heeft een koolstofatoom C en een stikstofatoom N die met elkaar zijn verbonden door een drievoudige binding..
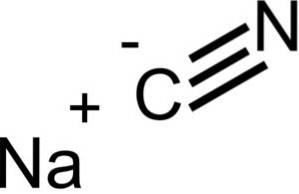
NaCN heeft dezelfde kristallijne structuur als NaCl, dus de kristallen zijn kubisch.
Nomenclatuur
-Natriumcyanide
-Natriumcyanide
Eigendommen
Fysieke toestand
Hygroscopische witte kristallijne vaste stof (absorbeert water uit de omgeving).
Molecuulgewicht
49,007 g / mol
Smeltpunt
563,7 ºC
Kookpunt
1496 ºC
Vlampunt
Het is niet brandbaar. Maar bij blootstelling aan vuur worden HCN-waterstofcyanide en stikstofoxiden geproduceerd..
Dichtheid
1.595 g / cm3 bij 20 ºC
Oplosbaarheid
Zeer oplosbaar in water: 48 g / 100 ml bij 10 ° C, 82 g / 100 ml bij 35 ° C. Enigszins oplosbaar in alcohol
Dissociatieconstante
Het wordt gehydrolyseerd in een waterige oplossing waarbij waterstofcyanide HCN wordt gegenereerd. De constante van deze hydrolyse is Kh = 2,5 x 10-5.
pH
Waterige NaCN-oplossingen zijn sterk alkalisch
Chemische eigenschappen
Wanneer het wordt opgelost in water, scheidt het zich af in zijn Na-ionen+ en CN-. In waterige oplossing het cyanide-ion CN- neem een proton H+ van water HtweeOf het vormen van HCN en een OH-ion-, dus de oplossing wordt alkalisch.
CN- + H.tweeO → HCN + OH-
Om deze reden ontleden zijn waterige oplossingen snel wanneer ze worden bewaard, waarbij waterstofcyanide HCN wordt gevormd..
Het is corrosief ten opzichte van aluminium. Zijn oplossingen lossen goud Au en zilver Ag gemakkelijk op in aanwezigheid van lucht..
Het is een chelaatvormer omdat het cyanide-anion CN- kan gemakkelijk binden aan andere metalen, zoals zilver, goud, kwik, zink, cadmium, enz..
Heeft een zwakke, bittere amandelgeur.
Risico's
Er moet met de grootste zorg mee worden omgegaan. Het is een zeer giftige stof, remt belangrijke stofwisselingsprocessen en leidt tot de dood door inslikken, inademen, opname via de huid of contact met de ogen..
Bij inademing lost NaCN op in het slijmvlies van de luchtwegen en komt het in de bloedbaan terecht. Het cyanide-ion van NaCN heeft een sterke affiniteit voor ijzer in de oxidatietoestand van +3, dat wil zeggen het ijzer (III) kation Fe3+.
Wanneer cyanide wordt geabsorbeerd, reageert het snel met Fe3+ van een belangrijk enzym van de mitochondriën van de cellen (cytochroomoxidase), waardoor bepaalde processen van de ademhaling hiervan worden voorkomen.
Daarom wordt cellulaire ademhaling geremd of vertraagd en ontstaat er cytotoxische hypoxie. Het betekent dat cellen en weefsels geen zuurstof kunnen gebruiken, vooral hersen- en hartcellen.
Op deze manier treedt permanente of dodelijke schade aan het lichaam op. Dit kan zowel bij mensen als bij dieren voorkomen..
Als het wordt ingeslikt, veroorzaakt het congestie van de bloedvaten en corrosie van het maagslijmvlies, naast de bovengenoemde.

Het is niet brandbaar, maar in contact met zuren komt HCN vrij dat licht ontvlambaar en giftig is.
Als het smelt met nitrieten of chloraten, kan het exploderen.
Het verkrijgen van
Kan worden verkregen met natrium Na, ammoniak NH3 en koolstof C. Natrium reageert met ammoniak om natriumamide NaNH te geventwee
2 Na + 2 NH3 → 2 NaNHtwee + H.twee
Natriumamide wordt met houtskool verwarmd tot 600 ° C en produceert natriumcyanamide NatweeNCN, dat vervolgens wordt omgezet in natriumcyanide met houtskool bij 800 ºC:
2 NaNHtwee + C → 2 Htwee↑ + NatweeNCN
NatweeNCN + C → 2 NaCN
Een andere methode is om calciumcyanamide CaNCN en koolstof C te smelten met natriumcarbonaat NatweeCO3
CaNCN + C + NatweeCO3 → CaCO3 + 2 NaCN
Het kan ook worden bereid door stikstofgas N te leidentwee door een heet mengsel van natriumcarbonaat NatweeCO3 en koolstof C in poedervorm, met ijzer Fe als katalysator of reactieversneller:
NatweeCO3 + 4 C + Ntwee → 2 NaCN + 3 CO ↑
Toepassingen
Bij de winning van goud- en zilvermineralen. Gevolgen
Natriumcyanide wordt al lang gebruikt om de metalen goud en zilver uit hun ertsen te halen..
Het cyanide dat in het proces wordt gebruikt, wordt gerecycled, maar er ontsnapt iets in de afvalvijver samen met de niet-teruggewonnen zware metalen.
Vogels, vleermuizen en andere dieren die uit deze cyanide-lagunes drinken, zijn vergiftigd.
Er zijn gegevens van een dam in Roemenië die een afvalvijver isoleerde en werd beschadigd door een weersomstandigheden..
Als gevolg hiervan kwamen tonnen cyanide vrij in de Sasar-rivier en nabijgelegen watervoerende systemen zoals de rivieren Lapus, Somes en Tisza, die eindigen in de Donau..
Dit veroorzaakte een cascade van sterfgevallen door dieren, of met andere woorden, een ecologische ramp..

Bij de productie van andere chemische verbindingen
NaCN-natriumcyanide wordt gebruikt bij de synthese van verschillende soorten organische verbindingen.
Er worden bijvoorbeeld pigmenten en kleurstoffen (inclusief optische witmakers), verbindingen voor gebruik in de landbouw of landbouwchemicaliën en diverse farmaceutische producten bereid..
Het wordt ook gebruikt om chelaatvormers of sekwestreermiddelen voor metaalionen te verkrijgen..
Verbindingen die nitrilen worden genoemd, worden bereid met natriumcyanide NaCN, dat bij behandeling met hete zure of alkalische waterige oplossing carbonzuren kan verkrijgen.
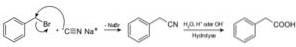
Hiermee kunnen vetzuren worden bereid met cyaangroepen, cyaniden van zware metalen en blauwzuur of HCN-waterstofcyanide.
In de metaalindustrie
NaCN wordt gebruikt in oplossingen die worden gebruikt bij het galvaniseren of galvaniseren van metalen (coating van metalen met anderen), bijvoorbeeld zink.
Het is een onderdeel van gehard staal. Dient ook bij het reinigen van metalen.
In andere toepassingen
Natriumcyanide is een tussenproduct bij de vervaardiging van nylon.
Dient voor de afscheiding van mineralen door schuimflotatie.
Toepassingen buiten gebruik, in twijfel getrokken of zeer zeldzaam
NaCN werd gebruikt om knaagdieren, zoals konijnen en ratten, en hun holen te doden, en om termietennesten te doden.
Momenteel wordt het af en toe gebruikt om coyotes, vossen en wilde honden te elimineren. Gebruikt in capsulevorm als enkele of meervoudige doses op weilanden, jachtgebieden en bossen.
Vanwege de extreme toxiciteit mag NaCN alleen worden gebruikt door getrainde personen..
Dit gebruik wordt als zeer gevaarlijk voor mensen beschouwd, maar er zijn er die het nog steeds gebruiken.

In de landbouw werd het vroeger gebruikt om citrusvruchtenbomen en ander fruit te ontsmetten. Het werd ook gebruikt als insecticide en miticide (mijtverwijderaar) om na de oogst te worden toegepast, voor niet-opgeslagen citrusvruchten of voor het fumigeren van vrachtwagens die werden gebruikt om ze te vervoeren. Het werd ook gebruikt om schepen, treinwagons en magazijnen te ontsmetten..
Al deze toepassingen zijn in twijfel getrokken vanwege de hoge toxiciteit van natriumcyanide. Om deze reden wordt het niet meer of slechts zeer zelden en onder zeer gecontroleerde omstandigheden gebruikt..
Referenties
- ONS. Nationale bibliotheek van geneeskunde. (2019). Natriumcyanide. Opgehaald van pubchem.ncbi.nlm.nih.gov.
- Kirk-Othmer (1994). Encyclopedie van chemische technologie. Vierde druk. John Wiley & Sons.
- Hurst, H.E. en Martin, M.D. (2017). Toxicologie. Cyanide. In farmacologie en therapeutica voor tandheelkunde (zevende editie). Opgehaald van sciencedirect.com.
- Coppock, R.W. en Dziwenka, M. (2015). Bedreigingen voor wilde dieren door agenten voor chemische oorlogsvoering. In Handbook of Toxicology of Chemical Warfare Agents (Second Edition). Opgehaald van sciencedirect.com.
- Morrison, R.T. en Boyd, R.N. (2002). Organische chemie. 6e editie. Prentice-Hall.

Niemand heeft nog op dit artikel gereageerd.