
Cycloalkanen eigenschappen, reacties, toepassingen, voorbeelden

De cycloalkanen zijn een familie van verzadigde koolwaterstoffen met de algemene formule CnH.2n dat valt samen met dat van de alkenen; met het verschil dat de schijnbare onverzadiging niet te wijten is aan een dubbele binding, maar aan een ring of cyclus. Daarom worden ze beschouwd als isomeren van alkenen.
Deze worden gevormd wanneer lineaire alkanen de uiteinden van hun ketens verbinden om een gesloten structuur te creëren. Net als alkanen kunnen cycloalkanen verschillende groottes, molecuulgewichten, substituties of zelfs systemen vertonen die uit meer dan één ring bestaan (polycyclisch).
Anders zijn ze chemisch en fysisch vergelijkbaar met alkanen. Ze hebben alleen koolstof- en waterstofatomen, zijn neutrale moleculen en werken daarom samen via Van der Walls-krachten. Ze dienen ook als brandstof en geven warmte af wanneer ze branden in aanwezigheid van zuurstof..
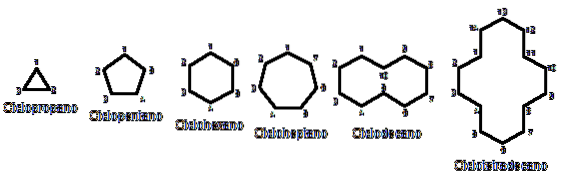
Waarom zijn cycloalkanen instabieler dan hun tegenhangers met een open keten? De reden kan worden vermoed door vanuit vogelperspectief de voorbeelden van cycloalkanen in de bovenstaande afbeelding te observeren: er zijn sterische (ruimtelijke) spanningen en belemmeringen.
Merk op dat hoe minder koolstoffen er zijn (weergegeven in blauw), hoe meer gesloten de structuur is; en het tegenovergestelde gebeurt wanneer ze toenemen en als een ketting worden.
Kleine cycloalkanen zijn gasvormig en naarmate ze groter worden, nemen ook hun intermoleculaire krachten toe. Bijgevolg kunnen het vloeistoffen zijn die in staat zijn om vetten en apolaire moleculen, smeermiddelen of vaste stoffen op te lossen die donkere kleuren en eigenschappen vertonen zoals die van asfalt..
Artikel index
- 1 Fysische en chemische eigenschappen
- 1.1 Polariteit
- 1.2 Intermoleculaire interacties
- 1.3 Verzadiging
- 1.4 Stabiliteit
- 2 Nomenclatuur
- 3 Structuur
- 3.1 Conformaties
- 4 reacties
- 5 toepassingen
- 6 Voorbeelden van cycloalkanen
- 7 referenties
Fysische en chemische eigenschappen
Polariteit
Doordat ze alleen zijn samengesteld uit koolstofatomen en waterstofatomen, atomen die op zichzelf niet al te veel verschillen in elektronegativiteit, zijn de cycloalkaanmoleculen apolair en missen ze daarom een dipoolmoment.
Ze kunnen geen interactie vertonen via dipool-dipoolkrachten, maar zijn specifiek afhankelijk van Londense krachten, die zwak zijn maar toenemen met de molecuulmassa. Daarom zijn kleine cycloalkanen (met minder dan vijf koolstofatomen) gasvormig..
Intermoleculaire interacties
Aan de andere kant, omdat het ringen zijn, hebben cycloalkanen een groter contactoppervlak, wat de Londense krachten tussen hun moleculen begunstigt. Ze groeperen en werken dus op een betere manier samen in vergelijking met alkanen; en daarom zijn de kook- en smeltpunten hoger.
Ook omdat ze twee waterstofatomen minder hebben (C.nH.2n voor cycloalkanen en CnH.2n + 2 voor alkanen), ze zijn lichter; en daaraan toevoegend het feit van het grotere contactoppervlak, neemt het volume dat door zijn moleculen wordt ingenomen af, en daarom zijn ze dichter.
Verzadiging
Waarom worden cycloalkanen geclassificeerd als verzadigde koolwaterstoffen? Omdat ze geen manier hebben om een waterstofmolecuul op te nemen; tenzij de ring wordt geopend, in welk geval ze eenvoudige alkanen zouden worden. Om een koolwaterstof als verzadigd te beschouwen, moet deze het maximaal mogelijke aantal C-H-bindingen hebben.
Stabiliteit
Chemisch gezien lijken ze erg op alkanen. Beide hebben C-C- en C-H-bindingen, die niet zo gemakkelijk te verbreken zijn om andere producten te produceren. Hun relatieve stabiliteit verschilt echter, wat experimenteel kan worden geverifieerd door hun verbrandingswarmte (ΔHkam.
Bij het vergelijken van de ΔHkam voor propaan en cyclopropaan (weergegeven door een driehoek in de afbeelding), hebben we respectievelijk 527,4 kcal / mol en 498,9 kcal / mol.
Het detail is dat het cyclopropaan, gebaseerd op de verbrandingswarmte van de alkanen, een ΔH moet hebbenkam lager (471 kcal / mol) omdat het drie methyleengroepen zijn, CHtweemaar in werkelijkheid geeft het meer warmte af, wat een grotere instabiliteit weerspiegelt dan geschat. Deze overtollige energie wordt dan toegeschreven aan de spanningen in de ring..
En in feite regelen en differentiëren deze spanningen de reactiviteit of stabiliteit van cycloalkanen, met betrekking tot alkanen, tegen specifieke reacties. Zolang de spanningen niet erg hoog zijn, hebben cycloalkanen de neiging stabieler te zijn dan hun respectievelijke alkanen..
Nomenclatuur
De IUPAC-nomenclatuur voor cycloalkanen verschilt niet veel van die voor alkanen. De eenvoudigste regel is om het voorvoegsel cyclo- te plaatsen bij de naam van het alkaan waaruit het cycloalkaan is gevormd.
Dus bijvoorbeeld uit n-hexaan, CH3CHtweeCHtweeCHtweeCHtweeCH3, je krijgt cyclohexaan (weergegeven door een zeshoek in de eerste afbeelding). Hetzelfde gebeurt met cyclopropaan, cyclobutaan, enz..
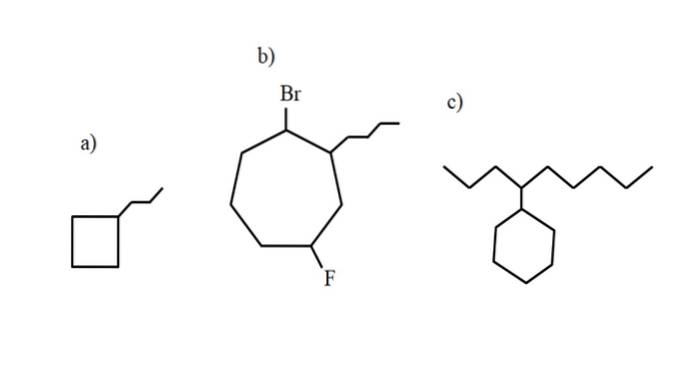
Deze verbindingen kunnen echter substituties van een van hun waterstofatomen ondergaan. Als het aantal koolstofatomen in de ring groter is dan dat van de alkylsubstituenten, wordt de ring als de hoofdketen genomen; dit is het geval bij a) voor de afbeelding hierboven.
Merk op dat in a) het cyclobutaan (het vierkant) meer koolstofatomen heeft dan de propylgroep die eraan vastzit; dan wordt deze verbinding genoemd als propylcyclobutaan.
Als er meer dan één substituent is, moeten ze in alfabetische volgorde worden genoemd en op zo'n manier dat ze het laagst mogelijke locatornummer hebben. Bijvoorbeeld, b) heet: 1-broom-4-fluor-2-butylcycloheptaan (en niet 1-broom-5-fluor-7-butylcycloheptaan, wat onjuist zou zijn).
En tenslotte, wanneer de alkylsubstituent meer koolstofatomen heeft dan de ring, wordt gezegd dat de laatste de substituentgroep van de hoofdketen is. Dus c) heet: 4-cyclohexylnonaan.
Structuur
Afgezien van de gesubstitueerde cycloalkanen, is het handig om alleen te focussen op hun structurele basis: de ringen. Deze zijn afgebeeld in de eerste afbeelding.
Het observeren ervan kan leiden tot het verkeerde idee dat dergelijke moleculen plat zijn; maar met uitzondering van cyclopropaan, zijn de oppervlakken 'zigzaggend', waarbij koolstofatomen stijgen of dalen ten opzichte van hetzelfde vlak.
Dit komt omdat alle koolstofatomen om te beginnen sp-gehybridiseerd zijn.3, en hebben daarom tetraëdrische geometrieën met bindingshoeken van 109,5º. Maar als de geometrie van de ringen zorgvuldig in de gaten wordt gehouden, is het onmogelijk dat hun hoeken deze zijn; de hoeken binnen de driehoek van cyclopropaan zijn bijvoorbeeld 60º.
Dit is wat bekend staat als hoekspanning. Hoe groter de ringen, de hoek tussen de C-C-bindingen is dichter bij 109,5 °, wat een afname van de genoemde spanning en een toename van de stabiliteit van het cycloalkaan veroorzaakt..
Een ander voorbeeld wordt waargenomen in cyclobutaan, waarvan de bindingshoeken 90 ° zijn. Reeds in cyclopentaan zijn de hoeken 108º, en van cyclohexaan wordt dan gezegd dat de hoekspanning stopt met het uitoefenen van zo'n opmerkelijk destabiliserend effect.
Conformaties
Naast hoekspanning zijn er nog andere factoren die bijdragen aan de stress die wordt ervaren door cycloalkanen..
De C-C-bindingen kunnen niet zomaar roteren, omdat dit zou betekenen dat de hele structuur zou "schudden". Deze moleculen kunnen dus zeer goed gedefinieerde ruimtelijke conformaties aannemen. Het doel van deze bewegingen is om de spanningen te verminderen die worden veroorzaakt door de verduistering van de waterstofatomen; dat wil zeggen, wanneer ze voor elkaar staan.
De conformaties voor cyclobutaan lijken bijvoorbeeld op een vlinder die met zijn vleugels klappert; die van cyclopentaan, een envelop; die van cyclohexaan, een boot of stoel, en hoe groter de ring, hoe groter het aantal vormen en vormen die ze in de ruimte kunnen aannemen.
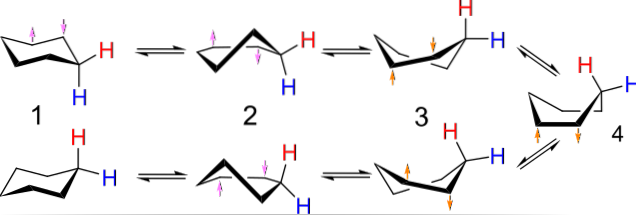
De afbeelding hierboven toont een voorbeeld van dergelijke conformaties voor cyclohexaan. Merk op dat de veronderstelde platte zeshoek eigenlijk meer lijkt op een stoel (aan de linkerkant van de afbeelding) of een boot (aan de rechterkant). Een waterstof wordt weergegeven door een rode letter en een andere door een blauwe letter om aan te geven hoe hun relatieve posities veranderen na de inversies..
In (1), wanneer waterstof loodrecht op het vlak van de ring staat, wordt gezegd dat het in de axiale positie is; en wanneer het parallel hieraan is, wordt gezegd dat het in de equatoriale positie is.
Reacties
De reacties die cycloalkanen kunnen ondergaan, zijn dezelfde als voor alkanen. Beide branden in aanwezigheid van overtollige zuurstof bij typische verbrandingsreacties om kooldioxide en water te produceren. Evenzo kunnen beide halogenaties ondergaan, waarbij een waterstof wordt vervangen door een halogeenatoom (F, Cl, Br, I).
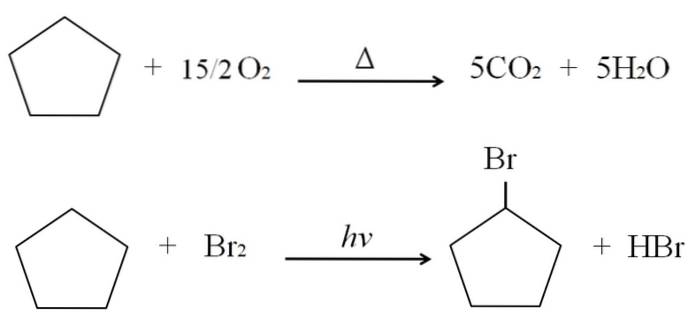
De verbrandings- en halogeneringsreacties voor cyclopentaan worden als voorbeeld hierboven getoond. Een mol ervan verbrandt in aanwezigheid van hitte en 7,5 mol moleculaire zuurstof om uiteen te vallen in COtwee en HtweeO. Aan de andere kant, in aanwezigheid van ultraviolette straling en broom, vervangt het een H door een Br, waardoor een gasvormig molecuul HBr vrijkomt.
Toepassingen
Het gebruik van cycloalkanen is sterk afhankelijk van hun koolstofgetal. De lichtste, en dus gasvormige, werden ooit gebruikt om de gaslampen van openbare verlichting van stroom te voorzien.
Vloeistoffen van hun kant hebben toepassingen als oplosmiddelen voor oliën, vetten of commerciële producten van niet-polaire aard. Onder deze kunnen cyclopentaan, cyclohexaan en cycloheptaan worden genoemd. Evenzo hebben ze de neiging om zeer vaak te worden gebruikt bij routinehandelingen in petroleumlaboratoria of bij de formulering van brandstoffen..
Als ze zwaarder zijn, kunnen ze als smeermiddel worden gebruikt. Anderzijds kunnen ze ook het uitgangsmateriaal vormen voor de synthese van geneesmiddelen; zoals carboplatine, dat een cyclobutaanring in zijn structuur bevat.
Voorbeelden van cycloalkanen
Ten slotte keren we terug naar het begin van het artikel: de afbeelding met verschillende ongesubstitueerde cycloalkanen.
Denk aan de geometrische figuren om cycloalkanen te onthouden: driehoek (cyclopropaan), vierkant (cyclobutaan), vijfhoek (cyclopentaan), zeshoek (cyclohexaan), zevenhoek (cycloheptaan), tienhoek (cyclodecaan), vijfhoek (cyclopentadecaan), enzovoort..
Hoe groter de ring, hoe minder hij lijkt op zijn respectievelijke geometrische figuur. We hebben al gezien dat cyclohexaan allesbehalve een zeshoek is; hetzelfde is duidelijker met cyclotetradecaan (veertien koolstofatomen).
Er komt een punt waarop ze zich zullen gedragen als kettingen die kunnen worden gevouwen om de spanning van hun schakels en verduistering zoveel mogelijk te verminderen..
Referenties
- Morrison, R. T. en Boyd, R, N. (1987). Organische chemie. 5e editie. Redactioneel Addison-Wesley Interamericana.
- Carey F. (2008). Organische chemie. (Zesde editie). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organische chemie. Amines. (10e editie.). Wiley plus.
- Chemie LibreTexts. (2 juni 2019). Cycloalkanen benoemen. Hersteld van: chem.libretexts.org
- Wikipedia. (2019). Cycloalkaan. Hersteld van: en.wikipedia.org
- Clark Jim. (2015). Introductie van alkanen en cycloalkanen. Hersteld van: chemguide.co.uk
- James Ashenhurst. (2019). Conformaties en cycloalkanen. Master Organische Chemie. Hersteld van: masterorganicchemistry.com
- Fernández Germán. (s.f.). Cycloalkanen-theorie. Organische chemie. Hersteld van: quimicaorganica.org


Niemand heeft nog op dit artikel gereageerd.