
Cycloalkines kenmerken, toepassingen, voorbeelden
De cycloalkines Het zijn organische verbindingen met een of meer drievoudige bindingen en een cyclische eenheid. De gecondenseerde moleculaire formules volgen de formule CnH.2n-4. Dus als n gelijk is aan 3, dan is de formule van genoemd cycloalkine C3H.twee.
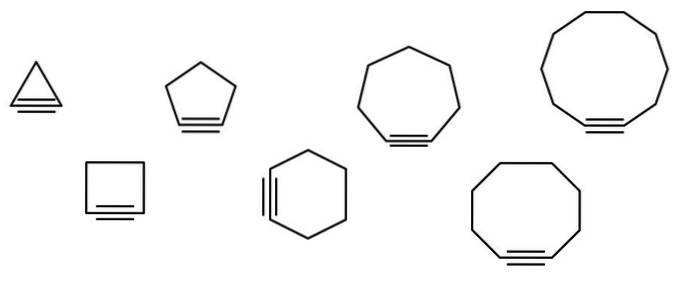
Een reeks geometrische figuren wordt geïllustreerd in de onderstaande afbeelding, maar ze bestaan eigenlijk uit voorbeelden van cycloalkines. Elk van hen kan worden beschouwd als een meer geoxideerde versie van de respectieve cycloalkanen (zonder dubbele of drievoudige bindingen). Als ze een heteroatoom missen (O, N, S, F, enz.), Zijn het slechts "eenvoudige" koolwaterstoffen..
De chemie rond cycloalkines is erg complex, en de mechanismen achter hun reacties zijn zelfs nog complexer. Ze vormen een startpunt voor de synthese van veel organische verbindingen, die op hun beurt onderhevig zijn aan mogelijke toepassingen.
Over het algemeen zijn ze zeer reactief, tenzij ze worden "vervormd" of gecomplexeerd met overgangsmetalen. Evenzo kunnen de drievoudige bindingen worden geconjugeerd met dubbele bindingen, waardoor cyclische eenheden binnen de moleculen ontstaan..
Als dit niet het geval is, zijn ze in hun eenvoudigste structuren in staat om kleine moleculen aan hun drievoudige bindingen toe te voegen..
Artikel index
- 1 Kenmerken van cycloalkines
- 1.1 Apolariteit en de drievoudige binding
- 1.2 Intermoleculaire krachten
- 1.3 Hoekspanning
- 2 Nomenclatuur
- 3 Toepassingen
- 4 voorbeelden
- 5 referenties
Kenmerken van cycloalkines
Apolariteit en de drievoudige band
Cycloalkinen worden gekenmerkt doordat ze apolaire moleculen zijn en daarom hydrofoob. Dit kan veranderen als ze in hun structuren een heteroatoom of functionele groep hebben die hen een aanzienlijk dipoolmoment geeft; zoals het gebeurt in heterocycli met drievoudige bindingen.
Maar wat is een drievoudige binding? Het zijn niet meer dan drie gelijktijdige interacties tussen twee koolstofatomen met sp-hybridisatie. De ene binding is eenvoudig (σ) en de andere twee π staan loodrecht op elkaar. Beide koolstofatomen hebben een vrije sp-orbitaal om te binden met andere atomen (R-C≡C-R).
Deze hybride orbitalen zijn 50% s karakter en 50% p karakter. Omdat de s-orbitalen meer doordringend zijn dan de p-orbitalen, maakt dit feit de twee koolstofatomen van de drievoudige binding zuurder (elektronenacceptoren) dan de koolstofatomen van de alkanen of alkenen..
Om deze reden vertegenwoordigt de drievoudige binding (≡) een specifiek punt voor elektronendonorsoorten om eraan toe te voegen, waardoor enkele bindingen worden gevormd..
Dit resulteert in het verbreken van een van de π-bindingen en wordt een dubbele binding (C = C). De toevoeging gaat door tot R4C-CR4, d.w.z. volledig verzadigde koolstofatomen.
Het bovenstaande kan ook op deze manier worden verklaard: de drievoudige binding is een dubbele onverzadiging.
Intermoleculaire krachten
Cycloalkinemoleculen werken samen door verstrooiingskrachten of Londense krachten en door interacties van het π-π-type. Deze interacties zijn zwak, maar naarmate de omvang van de cycli toeneemt (zoals de laatste drie aan de rechterkant van de afbeelding), slagen ze erin vaste stoffen te vormen bij kamertemperatuur en druk..
Hoekige spanning
De bindingen in de drievoudige binding bevinden zich op hetzelfde vlak en een lijn. Daarom heeft -C≡C- een lineaire geometrie, met de sp-orbitalen ongeveer 180º van elkaar gescheiden.
Dit heeft ernstige gevolgen voor de stereochemische stabiliteit van cycloalkinen. Het kost veel energie om de sp-orbitalen te "buigen", aangezien ze niet flexibel zijn.
Hoe kleiner de cycloalkine, hoe meer de sp-orbitalen moeten buigen om zijn fysieke bestaan mogelijk te maken. Bij analyse van het beeld kan van links naar rechts worden gezien dat in de driehoek de hoek van de bindingen met de zijkanten van de drievoudige binding zeer uitgesproken is; terwijl ze in het decagon minder steil zijn.
Hoe groter de cycloalkine, hoe dichter de bindingshoek van de sp-orbitalen de ideale 180 ° nadert. Het tegenovergestelde doet zich voor wanneer ze kleiner zijn, waardoor ze moeten buigen en een hoekspanning in hen, het destabiliseren van de cycloalkine.
De grotere cycloalkinen hebben dus een lagere hoekspanning, wat hun synthese en opslag mogelijk maakt. Hiermee is de driehoek de meest onstabiele cycloalkine en de tienhoek de meest stabiele van allemaal..
Eigenlijk is de cyclooctino (die met de achthoek) de kleinste en meest stabiele bekende maat; de andere bestaan alleen als tijdelijke tussenpersonen in chemische reacties.
Nomenclatuur
Dezelfde IUPAC-standaarden als voor cycloalkanen en cycloalkenen moeten worden toegepast voor het benoemen van cycloalkinen. Het enige verschil zit in het achtervoegsel -ico aan het einde van de naam van de organische verbinding..
De hoofdketen is degene met de drievoudige binding en begint te worden genummerd vanaf het uiteinde dat er het dichtst bij is. Als je bijvoorbeeld cyclopropaan hebt, dan wordt het hebben van een drievoudige binding cyclopropino genoemd (de driehoek in de afbeelding). Als er een methylgroep aan het bovenste hoekpunt is gehecht, dan is dat: 2-methylcyclopropino.
De koolstofatomen van R-C≡C-R hebben al hun vier bindingen, dus het ontbreekt aan waterstofatomen (zoals het geval is met alle cycloalkinen in de afbeelding). Dit gebeurt niet alleen als de drievoudige binding zich in een terminale positie bevindt, dat wil zeggen aan het einde van een ketting (R-C≡C-H).
Toepassingen
Cycloalkines zijn niet erg algemene verbindingen, dus hun toepassingen ook niet. Ze kunnen dienen als bindmiddelen (groepen die coördineren) voor overgangsmetalen, waardoor een oneindig aantal organometaalverbindingen ontstaat die voor zeer rigoureuze en specifieke toepassingen kunnen worden gebruikt..
Het zijn over het algemeen oplosmiddelen in hun meest verzadigde en stabiele vorm. Als ze uit heterocyclische groepen bestaan, naast interne cyclische C≡C-C = C-C≡C-eenheden, vinden ze interessante en veelbelovende toepassingen als antikankermedicijnen; Dat is het geval met dinemycine A. Er zijn andere verbindingen met structurele analogieën uit gesynthetiseerd..
Voorbeelden
De afbeelding toont zeven eenvoudige cycloalkinen, waarin er nauwelijks één drievoudige binding is. Van links naar rechts, met hun respectievelijke namen zijn er: cyclopropino, de driehoek; cyclobutino, het plein; cyclopentine, de vijfhoek; cyclohexine, de zeshoek; cycloheptine, de zevenhoek; cyclooctino, de achthoek; en cyclodecino, het decagon.
Op basis van deze structuren en door de waterstofatomen van de verzadigde koolstofatomen te vervangen, kunnen andere daarvan afgeleide verbindingen worden verkregen. Ze kunnen ook worden onderworpen aan oxidatieve omstandigheden om dubbele bindingen aan andere zijden van de cycli te genereren..
Deze geometrische eenheden kunnen deel uitmaken van een grotere structuur, waardoor de kans op functionalisering van de hele set toeneemt. Er zijn niet veel voorbeelden beschikbaar van cycloalkines, althans niet zonder in de diepe gebieden van organische synthese en farmacologie te duiken..
Referenties
- Francis A. Carey. Organische chemie. (Zesde editie, Pp.372, 375). Mc Graw Hill.
- Wikipedia. (2018). Cycloalkyne. Genomen uit: en.wikipedia.org
- William Reusch. (5 mei 2013). Organische verbindingen een naam geven. Genomen uit: 2.chemistry.msu.edu
- Anorganische scheikunde. Cycloalkines. Genomen van: fullquimica.com
- Patrizia Diana en Girolamo Cirrincione. (2015). Biosynthese van heterocycli van isolatie tot gencluster. Wiley, pagina 181.
- Interessante organische chemie en natuurlijke producten. (2015, 17 april). Cycloalkynes. Genomen uit: quintus.mickel.ch


Niemand heeft nog op dit artikel gereageerd.