
Cyclohexeen structuur, eigenschappen, synthese en toepassingen
De cyclohexeen is een cyclisch alkeen of olefine waarvan de molecuulformule C is6H.10. Het bestaat uit een kleurloze vloeistof, onoplosbaar in water en mengbaar met veel organische oplosmiddelen. Het wordt gekenmerkt doordat het ontvlambaar is en in de natuur wordt het meestal aangetroffen in koolteer.
Cyclohexeen wordt gesynthetiseerd door gedeeltelijke hydrogenering van benzeen en door dehydratatie van de alcohol cyclohexanol; dat wil zeggen, een meer geoxideerde vorm. Net als andere cycloalkenen ondergaat het elektrofiele reacties en reacties met vrije radicalen; bijvoorbeeld de halogeneringsreactie.

Dit cyclische alkeen (bovenste afbeelding) vormt azeotrope mengsels (niet scheidbaar door destillatie), met lagere alcoholen en azijnzuur. Het is niet erg stabiel bij langdurige opslag, omdat het uiteenvalt onder invloed van zonlicht en ultraviolette straling.
Cyclohexeen wordt gebruikt als oplosmiddel en kent daarom tal van toepassingen, zoals: stabilisator van benzine met een hoog octaangetal en voor de extractie van oliën.
Maar het belangrijkste is dat cyclohexeen dient als tussenproduct en grondstof voor het verkrijgen van talrijke zeer nuttige verbindingen, waaronder: cyclohexanon, adipinezuur, maleïnezuur, cyclohexaan, butadieen, cyclohexylcarbonzuur, enz..
Artikel index
- 1 Structuur van cyclohexeen
- 1.1 Intermoleculaire interacties
- 2 Eigenschappen
- 2.1 Chemische namen
- 2.2 Molecuulgewicht
- 2.3 Fysiek uiterlijk
- 2.4 Geur
- 2.5 Kookpunt
- 2.6 Smeltpunt
- 2.7 Vlampunt
- 2.8 Oplosbaarheid in water
- 2.9 Oplosbaarheid in organische oplosmiddelen
- 2.10 Dichtheid
- 2.11 Dampdichtheid
- 2.12 Dampspanning
- 2.13 Zelfontbranding
- 2.14 Ontleding
- 2.15 Viscositeit
- 2.16 Verbrandingswarmte
- 2.17 Verdampingswarmte
- 2.18 Oppervlaktespanning
- 2.19 Polymerisatie
- 2.20 Geurdrempelwaarde
- 2.21 Brekingsindex
- 2,22 pH
- 2.23 Stabiliteit
- 2.24 Reacties
- 3 Synthese
- 4 toepassingen
- 5 Risico's
- 6 referenties
Structuur van cyclohexeen
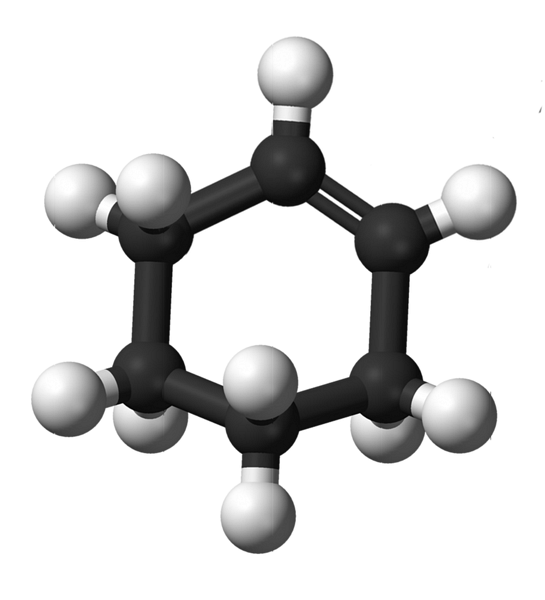
De bovenste afbeelding toont de structuur van cyclohexeen met een model van bollen en staven. Let op de zes-koolstofring en de dubbele binding, beide onverzadigingen van de verbinding. Vanuit dit perspectief lijkt het erop dat de ring plat is; maar dat is het helemaal niet.
Om te beginnen hebben de koolstofatomen van de dubbele binding sp-hybridisatietwee, waardoor ze een driehoekige vlakke geometrie hebben. Daarom bevinden deze twee koolstofatomen en de aangrenzende koolstofatomen zich in hetzelfde vlak; terwijl de twee koolstofatomen aan het andere uiteinde (van de dubbele binding) zich boven en onder dat vlak bevinden.
De onderstaande afbeelding illustreert perfect wat er zojuist is uitgelegd.

Merk op dat de zwarte band uit vier koolstofatomen bestaat: de twee van de dubbele binding en de andere ernaast. Het blootgestelde perspectief is het perspectief dat zou worden verkregen als een toeschouwer zijn oog recht voor de dubbele band zou plaatsen. Het is dan te zien dat een koolstof zich boven en onder dit vlak bevindt.
Omdat het cyclohexeenmolecuul niet statisch is, zullen de twee koolstofatomen uitwisselen: de ene zal naar beneden gaan terwijl de andere boven het vlak uitkomt. Dus je zou verwachten dat dat molecuul zich gedraagt.
Intermoleculaire interacties
Cyclohexeen is een koolwaterstof en daarom zijn de intermoleculaire interacties gebaseerd op de Londense dispersiekrachten.
Dit komt omdat het molecuul apolair is, zonder permanent dipoolmoment, en het molecuulgewicht de factor is die het meest bijdraagt aan het cohesie houden in de vloeistof..
Evenzo verhoogt de dubbele binding de mate van interactie, aangezien deze niet met dezelfde flexibiliteit kan bewegen als die van de andere koolstofatomen, en dit bevordert de interactie tussen naburige moleculen. Om deze reden heeft cyclohexeen een iets hoger kookpunt (83 ° C) dan dat van cyclohexaan (81 ° C)..
Eigendommen
Chemische namen
Cyclohexeen, tetrahydrobenzeen.
Molecuulgewicht
82,146 g / mol.
Fysiek uiterlijk
Kleurloze vloeistof.
Geur
Zoete geur.
Kookpunt
83 ºC bij 760 mmHg.
Smeltpunt
-103,5 ºC.
ontstekingspunt
-7 ºC (gesloten beker).
Oplosbaarheid in water
Vrijwel onoplosbaar (213 mg / L).
Oplosbaarheid in organische oplosmiddelen
Mengbaar met ethanol, benzeen, tetrachloorkoolstof, petroleumether en aceton. Verwacht wordt dat het apolaire verbindingen kan oplossen, zoals sommige allotropen van koolstof..
Dichtheid
0,810 g / cm3 bij 20ºC.
Dampdichtheid
2,8 (ten opzichte van lucht genomen als gelijk aan 1).
Dampdruk
89 mmHg bij 25ºC.
Zelfontbranding
244 ºC.
Ontleding
Het ontleedt in aanwezigheid van uraniumzouten, onder invloed van zonlicht en ultraviolette straling.
Viscositeit
0,625 mPascal bij 25 ºC.
Verbrandingswarmte
3.751,7 kJ / mol bij 25 ºC.
Warmte van verdamping
30,46 kJ / mol bij 25 ºC.
Oppervlaktespanning
26,26 mN / m.
Polymerisatie
Kan onder bepaalde omstandigheden polymeriseren.
Geurdrempel
0,6 mg / m3.
Brekingsindex
1.4465 bij 20 ºC.
pH
7-8 tot 20ºC.
Stabiliteit
Cyclohexeen is niet erg stabiel tijdens langdurige opslag. Blootstelling aan licht en lucht kan leiden tot de productie van peroxiden. Het is ook onverenigbaar met sterke oxidatiemiddelen..
Reacties
-Cycloalkenen ondergaan voornamelijk additiereacties, zowel elektrofiel als met vrije radicalen.
-Reageert met broom om 1,2-dibroomcyclohexaan te vormen.
-Het oxideert snel in aanwezigheid van kaliumpermanganaat (KMnO4.
-Het is in staat om een epoxide (cyclohexeenoxide) te produceren in aanwezigheid van peroxybenzoëzuur.
Synthese
Cyclohexeen wordt geproduceerd door zuurkatalyse van cyclohexanol:
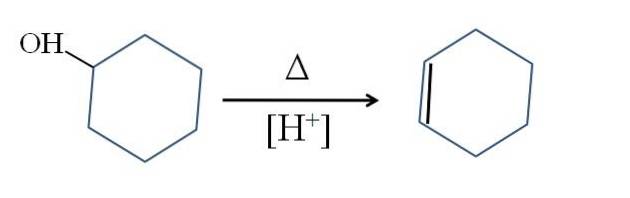
Het symbool Δ staat voor de warmte die nodig is om de uitgang van de OH-groep als watermolecuul in een zuur medium (-OHtwee+.
Cyclohexeen wordt ook geproduceerd door de gedeeltelijke hydrogenering van benzeen; dat wil zeggen, twee van zijn dubbele bindingen voegen een waterstofmolecuul toe:
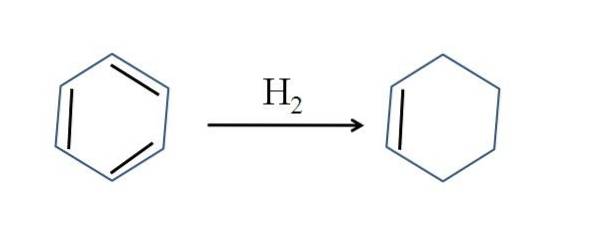
Hoewel de reactie eenvoudig lijkt, vereist het grote drukken van Htwee en katalysatoren.
Toepassingen
-Het heeft een nut als organisch oplosmiddel. Verder is het een grondstof voor de productie van adipinezuur, adipinealdehyde, maleïnezuur, cyclohexaan en cyclohexylcarbonzuur..
-Het wordt gebruikt bij de productie van cyclohexaanchloride, een verbinding die wordt gebruikt als tussenproduct bij de vervaardiging van farmaceutische producten en rubberadditieven.
-Cyclohexeen wordt ook gebruikt bij de synthese van cyclohexanon, een grondstof voor de productie van medicijnen, pesticiden, parfums en kleurstoffen..
-Cyclohexeen is betrokken bij de synthese van aminocyclohexanol, een verbinding die wordt gebruikt als oppervlakteactieve stof en emulgator.
-Bovendien kan cyclohexeen worden gebruikt voor de laboratoriumbereiding van butadieen. Deze laatste verbinding wordt gebruikt bij de vervaardiging van synthetisch rubber, bij de vervaardiging van autobanden en wordt ook gebruikt bij de vervaardiging van acrylplastic..
-Cyclohexeen is een grondstof voor de synthese van lysine, fenol, polycycloolefinehars en rubberadditieven.
-Het wordt gebruikt als stabilisator voor benzine met een hoog octaangetal.
-Intervenieert bij de synthese van waterdichte coatings, scheurvaste films en bindmiddelen voor coatings.
Risico's
Cyclohexeen is niet erg giftig, maar kan bij contact roodheid van de huid en ogen veroorzaken. Inademing kan hoesten en sufheid veroorzaken. Bovendien kan het inslikken slaperigheid, kortademigheid en misselijkheid veroorzaken..
Cyclohexeen wordt slecht geabsorbeerd uit het maagdarmkanaal, daarom worden geen ernstige systemische effecten verwacht bij inslikken. De maximale complicatie is de aspiratie door het ademhalingssysteem, wat chemische longontsteking kan veroorzaken.
Referenties
- Joseph F. Chiang en Simon Harvey Bauer. (1968). Moleculaire structuur van cyclohexeen. J. Am. Chem. Soc. 1969, 91, 8, 1898-1901.
- Karry Barnes. (2019). Cyclohexeen: gevaren, synthese en structuur. Studie. Hersteld van: study.com
- Morrison, R. T. en Boyd, R. N. (1987). Organische chemie. (5ta Editie.). Redactioneel Addison-Wesley Iberoamericana.
- PubChem. (2019). Cyclohexeen. Hersteld van: pubchem.ncbi.nlm.nih.gov
- Chemisch boek. (2019). Cyclohexeen. Hersteld van: chemicalbook.com
- Toxicologie Datanetwerk. (2017). Cyclohexeen. Toxnet. Hersteld van: toxnet.nlm.nih.gov
- Chemoxy. (s.f.). De structuurformule voor cyclohexeen is. Hersteld van: chemoxy.com



Niemand heeft nog op dit artikel gereageerd.