
Azijnzuurgeschiedenis, structuur, eigenschappen, gebruik
De azijnzuur of ethaanzuur is een kleurloze organische vloeistof waarvan de chemische formule CH is3COOH. Opgelost in water ontstaat een bekend mengsel, azijn genaamd, dat al heel lang als additief in voedsel wordt gebruikt. Azijn is een waterige oplossing van azijnzuur met een concentratie van ongeveer 5%.
Zoals de naam aangeeft, is het een zure verbinding en daarom heeft azijn pH-waarden lager dan 7. In aanwezigheid van zijn acetaatzout vormt het een buffersysteem dat effectief is in het reguleren van de pH tussen 2,76 en 6,76; dat wil zeggen, het houdt de pH binnen dat bereik met matige toevoegingen van een base of een zuur.

De formule is voldoende om te beseffen dat het wordt gevormd door de vereniging van een methylgroep (CH3) en een carboxylgroep (COOH). Na mierenzuur is HCOOH een van de eenvoudigste organische zuren; wat ook het eindpunt vertegenwoordigt van veel fermentatieprocessen.
Zo kan azijnzuur worden geproduceerd door aërobe en anaërobe bacteriële fermentatie en door chemische synthese, waarbij het methanolcarbonyleringsproces het belangrijkste productiemechanisme is..
Naast het dagelijkse gebruik als saladedressing, vormt het in de industrie de grondstof voor de productie van celluloseacetaat, een polymeer dat wordt gebruikt om fotografische films te maken. Bovendien wordt azijnzuur gebruikt bij de synthese van polyvinylacetaat, gebruikt om een lijm voor hout te maken..
Wanneer de azijn sterk geconcentreerd is geworden, wordt het niet langer als zodanig genoemd en wordt het ijsazijn genoemd. Bij deze concentraties is het, hoewel het een zwak zuur is, zeer corrosief en kan het irritatie van de huid en luchtwegen veroorzaken door oppervlakkig te ademen. IJsazijn wordt gebruikt als oplosmiddel in organische syntheses.
Artikel index
- 1 Geschiedenis
- 1.1 1800
- 1.2 1900
- 2 Structuur van azijnzuur
- 3 Fysische en chemische eigenschappen
- 3.1 Chemische namen
- 3.2 Moleculaire formule
- 3.3 Fysiek voorkomen
- 3.4 Geur
- 3.5 Smaak
- 3.6 Kookpunt
- 3.7 Smeltpunt
- 3.8 Vlampunt
- 3.9 Oplosbaarheid in water
- 3.10 Oplosbaarheid in organische oplosmiddelen
- 3.11 Dichtheid
- 3.12 Dampdichtheid
- 3.13 Dampspanning
- 3.14 Ontleding
- 3.15 Viscositeit
- 3.16 Corrosiviteit
- 3.17 Verbrandingswarmte
- 3.18 Verdampingswarmte
- 3,19 pH
- 3.20 Oppervlaktespanning
- 3,21 pKa
- 3.22 Chemische reacties
- 4 Productie
- 4.1 Oxidatieve of aërobe fermentatie
- 4.2 Anaërobe fermentatie
- 4.3 Carbonylering van methanol
- 4.4 Oxidatie van aceetaldehyde
- 5 toepassingen
- 5.1 Industrieel
- 5.2 Als oplosmiddel
- 5.3 Artsen
- 5.4 In voedsel
- 6 referenties
Verhaal
De man die tot talrijke culturen behoort, heeft de fermentatie van talrijke vruchten, peulvruchten, granen enz. Gebruikt om alcoholische dranken te verkrijgen, product van de omzetting van suikers, zoals glucose, in ethanol, CH3CHtweeOh.
Waarschijnlijk omdat de oorspronkelijke methode voor de productie van alcohol en azijn fermentatie is, misschien door te proberen alcohol te produceren op een onbepaalde tijd, vele eeuwen geleden, werd azijn per ongeluk verkregen. Let op de gelijkenis tussen de chemische formules van azijnzuur en ethanol.
Al in de 3e eeuw voor Christus beschreef de Griekse filosoof Theophastus de werking van azijn op metalen voor de productie van pigmenten, zoals loodwit.
1800
In 1823 werd in Duitsland een torenvormige apparatuur ontworpen voor de aërobe fermentatie van verschillende producten, om azijnzuur in de vorm van azijn te verkrijgen..
In 1846 bereikte Herman Foelbe voor het eerst de synthese van azijnzuur door het gebruik van anorganische verbindingen. De synthese begon met de chlorering van koolstofdisulfide en eindigde, na twee reacties, met een elektrolytische reductie tot azijnzuur.
Aan het einde van de 19e eeuw en het begin van de 20e eeuw, als gevolg van het onderzoek van J. Weizmann, begon de bacterie Clostridium acetobutylicum te worden gebruikt voor de productie van azijnzuur, door middel van anaërobe fermentatie..
1900
Aan het begin van de 20e eeuw was de dominante technologie de productie van azijnzuur door oxidatie van aceetaldehyde.
In 1925 ontwierp Henry Dreyfus van het Britse Celanese een proeffabriek voor de carbonylering van methanol. Later, in 1963, introduceerde het Duitse bedrijf BASF het gebruik van kobalt als katalysator.
Otto Hromatka en Heinrich Ebner (1949) ontwierpen een tank met een roersysteem en luchttoevoer voor aërobe fermentatie, bedoeld voor de productie van azijn. Dit werktuig is, met enkele aanpassingen, nog steeds in gebruik.
In 1970 gebruikte het Noord-Amerikaanse bedrijf Montsanto een katalysatorsysteem op basis van rhodium voor de carbonylering van methanol..
Vervolgens introduceerde het BP-bedrijf in 1990 het Cativa-proces met het gebruik van de iridiumkatalysator voor hetzelfde doel. Deze methode bleek efficiënter en minder milieubelastend te zijn dan de Montsanto-methode..
Structuur van azijnzuur
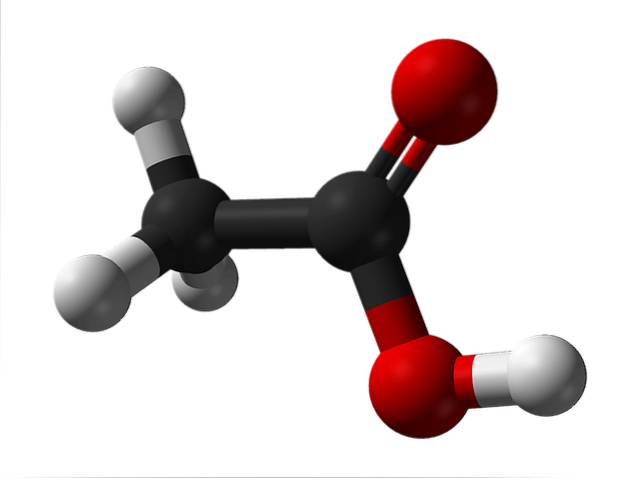
De bovenste afbeelding toont de structuur van azijnzuur weergegeven met een bolletjes- en staafmodel. De rode bollen komen overeen met de zuurstofatomen, die op hun beurt tot de carboxylgroep -COOH behoren. Daarom is het een carbonzuur. Aan de rechterkant van de structuur bevindt zich de methylgroep, -CH3.
Zoals te zien is, is het een heel klein en eenvoudig molecuul. Het vertoont een permanent dipoolmoment vanwege de -COOH-groep, waardoor azijnzuur ook achtereenvolgens twee waterstofbruggen kan vormen.
Het zijn deze bruggen die de CH-moleculen ruimtelijk oriënteren.3COOH om dimeren te vormen in de vloeibare (en gasvormige) toestand.

Boven in de afbeelding kun je zien hoe de twee moleculen zijn gerangschikt om de twee waterstofbruggen te vormen: O-H-O en O-H-O. Om azijnzuur te verdampen, moet voldoende energie worden geleverd om deze interacties te verbreken; reden waarom het een vloeistof is met een kookpunt hoger dan dat van water (ongeveer 118 ° C).
Fysische en chemische eigenschappen
Chemische namen
Zuur:
-Azijnzuur
-Ethanoic
-Ethyl
Moleculaire formule
CtweeH.4OFtwee of CH3COOH.
Fysiek uiterlijk
Kleurloze vloeistof.
Geur
Kenmerkende hectare.
Smaak
Brandend.
Kookpunt
244ºF tot 760 mmHg (117,9ºC).
Smeltpunt
61,9 ºF (16,6 ºC).
ontstekingspunt
112 ºF (open beker) 104 ºF (gesloten beker).
Oplosbaarheid in water
106 mg / ml bij 25 ºC (het is in alle verhoudingen mengbaar).
Oplosbaarheid in organische oplosmiddelen
Het is oplosbaar in ethanol, ethylether, aceton en benzeen. Het is ook oplosbaar in tetrachloorkoolstof.
Dichtheid
1,051 g / cm3 bij 68ºF (1,044 g / cm3 bij 25ºC).
Dampdichtheid
2,07 (ten opzichte van lucht = 1).
Dampdruk
15,7 mmHg bij 25 ºC.
Ontleding
Bij verhitting boven 440 ºC ontleedt het om kooldioxide en methaan te produceren.
Viscositeit
1056 mPascal bij 25 ºC.
Corrosiviteit
IJsazijn is zeer corrosief en de inname ervan kan bij de mens ernstige laesies van de slokdarm en pylorus veroorzaken..
Verbrandingswarmte
874,2 kJ / mol.
Warmte van verdamping
23,70 kJ / mol bij 117,9 ºC.
23,36 kJ / mol bij 25,0 ºC.
pH
-Een oplossing met een concentratie van 1 M heeft een pH van 2,4
- Voor een 0,1 M-oplossing is de pH 2,9
- En 3,4 als de oplossing 0,01 M is
Oppervlaktespanning
27,10 mN / m bij 25 ºC.
pKa
4,76 bij 25 ° C.
Chemische reacties
Azijnzuur is corrosief voor veel metalen, waarbij H-gas vrijkomttwee en het vormen van metaalzouten die acetaten worden genoemd. Met uitzondering van chroom (II) acetaat, zijn acetaten oplosbaar in water. De reactie met magnesium wordt weergegeven door de volgende chemische vergelijking:
Mg (s) + 2 CH3COOH (ag) => (CH3COO)tweeMg (ag) + Htwee (g)
Door reductie vormt azijnzuur ethanol. Het kan ook azijnzuuranhydride vormen door het verlies van water uit twee watermoleculen..
Productie
Zoals eerder vermeld, produceert fermentatie azijnzuur. Deze fermentatie kan aëroob zijn (in aanwezigheid van zuurstof) of anaëroob (zonder zuurstof).
Oxidatieve of aërobe fermentatie
Bacteriën van het geslacht Acetobacter kunnen inwerken op ethanol of ethylalcohol, waardoor het oxideert tot azijnzuur in de vorm van azijn. Met deze methode kan azijn met een concentratie van 20% azijnzuur worden geproduceerd..
Deze bacteriën zijn in staat azijn te produceren en werken op een breed scala aan inputs, waaronder verschillende soorten fruit, gefermenteerde peulvruchten, mout, granen zoals rijst of andere groenten die ethylalcohol bevatten of kunnen produceren..
De chemische reactie die wordt gefaciliteerd door bacteriën van het geslacht Acetobacter is als volgt:
CH3CHtweeOH + Otwee => CH3COOH + HtweeOF
Oxidatieve fermentatie wordt uitgevoerd in tanks met mechanische beweging en zuurstoftoevoer..
Anaërobe fermentatie
Het is gebaseerd op het vermogen van sommige bacteriën om azijnzuur te produceren door direct in te werken op suikers, zonder dat er tussenstoffen nodig zijn voor de productie van azijnzuur..
C6H.12OF6 => 3CH3COOH
De bacterie die in dit proces tussenkomt, is Clostridium acetobutylicum, dat in staat is om naast azijnzuur in te grijpen in de synthese van andere verbindingen..
Acetogene bacteriën kunnen azijnzuur produceren en werken op moleculen die uit slechts één koolstofatoom bestaan; dat is het geval met methanol en koolmonoxide.
Anaërobe fermentatie is goedkoper dan oxidatieve fermentatie, maar heeft als beperking dat bacteriën van het geslacht Clostridium niet erg resistent zijn tegen zuurgraad. Dit beperkt zijn vermogen om azijn te produceren met een hoge concentratie azijnzuur, zoals wordt bereikt bij oxidatieve fermentatie..
Carbonylering van methanol
Methanol kan reageren met koolmonoxide om azijnzuur te produceren in aanwezigheid van katalysatoren
CH3OH + CO => CH3COOH
Met joodmethaan als katalysator verloopt de carbonylering van methanol in drie fasen:
In een eerste fase reageert joodwaterstofzuur (HI) met methanol, waarbij joodmethaan wordt geproduceerd, dat in een tweede fase reageert met koolmonoxide, waarbij de verbinding joodacetaldehyde (CH3COI). Vervolgens de CH3COI hydrateert om azijnzuur te produceren en HI te regenereren.
Het Monsanto-proces (1966) is een methode voor de bereiding van azijnzuur door katalytische carbonylering van methanol. Het wordt ontwikkeld bij een druk van 30 tot 60 atm, bij een temperatuur van 150 - 200 ºC en met behulp van een rhodiumkatalysatorsysteem..
Het Monsanto-proces werd grotendeels vervangen door het Cativa (1990) -proces ontwikkeld door BP Chemicals LTD, dat een iridiumkatalysator gebruikt. Dit proces is goedkoper en minder vervuilend.
Acetaldehyde oxidatie
Deze oxidatie vereist metallische katalysatoren zoals naftenaten, mangaanzouten, kobalt of chroom..
2 CH3CHO + Otwee => 2 CH3COOH
Acetaldehyde-oxidatie kan een zeer hoge opbrengst hebben die 95% kan bereiken met geschikte katalysatoren. De bijproducten van de reactie worden door destillatie van azijnzuur gescheiden.
Na de carbonyleringsmethode van methanol is de oxidatie van aceetaldehyde de tweede vorm in percentage van de industriële productie van azijnzuur.
Toepassingen
Industrieel
-Azijnzuur reageert met ethyleen in aanwezigheid van zuurstof om vinylacetaatmonomeer te vormen, waarbij palladium als reactiekatalysator wordt gebruikt. Vinylacetaat polymeriseert tot polyvinylacetaat, dat wordt gebruikt als component in verf en kleefstof..
-Reageert met verschillende alcoholen om esters te produceren, waaronder ethylacetaat en propylacetaat. Acetaatesters worden gebruikt als oplosmiddelen voor inkt, nitrocellulose, coatings, vernissen en acryllakken..
-Door de condensatie van twee moleculen azijnzuur, verliest één molecuul van een molecuul, azijnzuuranhydride, CH3CO-O-COCH3. Deze verbinding is betrokken bij de synthese van celluloseacetaat, een polymeer dat een synthetisch weefsel vormt en wordt gebruikt bij de productie van fotografische films..
Als oplosmiddel
-Het is een polair oplosmiddel met het vermogen om waterstofbruggen te vormen. Het is in staat polaire verbindingen zoals anorganische zouten en suikers op te lossen, maar het lost ook niet-polaire verbindingen op zoals oliën en vetten. Bovendien is azijnzuur mengbaar met polaire en niet-polaire oplosmiddelen..
-De mengbaarheid van azijnzuur in alkanen hangt af van de verlenging van de keten hiervan: naarmate de lengte van de keten van alkanen toeneemt, neemt de mengbaarheid met azijnzuur af.
Artsen
-Verdund azijnzuur wordt gebruikt als een antisepticum, plaatselijk aangebracht, met het vermogen om bacteriën zoals streptokokken, stafylokokken en pseudomonas aan te vallen. Door deze werking wordt het gebruikt bij de behandeling van huidinfecties.
-Azijnzuur wordt gebruikt bij endoscopie van de Barrett-slokdarm. Dit is een aandoening waarbij het slijmvlies van de slokdarm verandert en lijkt op het slijmvlies van de dunne darm..
-Een 3% azijnzuurgel lijkt een effectieve aanvulling te zijn op de behandeling met het vaginale medicijn Misoprostol, en veroorzaakt medische abortus in het middelste trimester, vooral bij vrouwen met een vaginale pH van 5 of hoger..
-Het wordt gebruikt als vervanging voor chemische peeling. Er zijn echter complicaties opgetreden bij dit gebruik, aangezien er ten minste één geval van brandwonden bij een patiënt is gemeld.
In eten
Azijn wordt al heel lang gebruikt als smaakmaker en smaakstof in voedingsmiddelen, waardoor dit de meest bekende toepassing van azijnzuur is..
Referenties
- Byju's. (2018). Wat is ethaanzuur? Hersteld van: byjus.com
- PubChem. (2018). Azijnzuur. Hersteld van: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2018). Azijnzuur. Hersteld van: en.wikipedia.org
- Chemisch boek. (2017). Ijsazijn. Hersteld van: chemicalbook.com
- Azijnzuur: wat is het en waarvoor dient het? Hersteld van: acidoacetico.info
- Helmenstine, Anne Marie, Ph.D. (22 juni 2018). Wat is ijsazijn? Hersteld van: thoughtco.com



Niemand heeft nog op dit artikel gereageerd.