
Broomzuur (HBrO3) eigenschappen, risico's en toepassingen
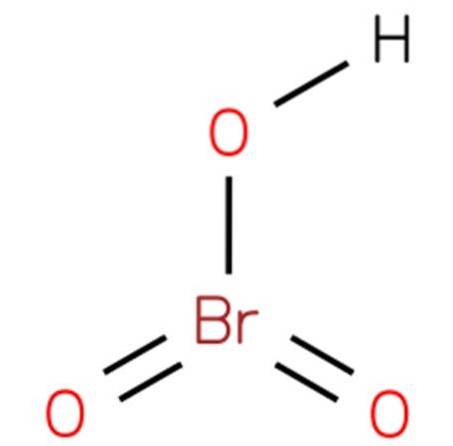
De broomzuur, Ook bekend als waterstofbromaat of broomzuur (V), het is een chemische verbinding met de formule HBrO3. Het is een broomoxzuur met een structuur die analoog is aan chloorzuur (EMBL-EBI, 2014). De verbinding is een zeer sterk zuur. De structuur is weergegeven in figuur 1 (EMBL-EBI, 2008).
Om broomzuur te bereiden, wordt gewoonlijk een oplosbaar bromaat opgelost in water en wordt een oplosbaar bariumzout toegevoegd. Laag oplosbaar bariumbromaat slaat neer.
Het bariumbromaat kan vervolgens worden opgelost in water en aangezuurd met zwavelzuur om het in wezen onoplosbare bariumsulfaat neer te slaan en het broomzuur achter te laten (zie afbeelding hierboven):
2KBrO3 (aq) + BaCl2 (aq) -> Ba (BrO3) 2 (s) + 2KCl (aq)
Ba (BrO3) 2 (aq) + H2SO4 (aq) -> 2HBrO3 + BaSO4
De verbinding kan ook worden geproduceerd door ontleding van broompentachloride in alkalische oplossing volgens de reactie:
BrCl5 + 3 H2O → HBrO3 + 5 HCl
Broomzuur is een sterk oxidatiemiddel. Het bromaat-ion kan verder worden geoxideerd met elementair fluor of xenondifluoride in aanwezigheid van base, oxidatie vergezeld van kleine explosies en de teflonbuis kan in brand vliegen (My Favorite Chemicals, S.F.).
Artikel index
- 1 Fysische en chemische eigenschappen van broomzuur
- 2 Reactiviteit en gevaren
- 2.1 In geval van contact met de ogen
- 2.2 Bij huidcontact
- 2.3 Bij inademing
- 3 toepassingen
- 4 referenties
Fysische en chemische eigenschappen van broomzuur
Broomzuur bestaat alleen in een kleurloze oplossing (tot 50% g / v) die gelig wordt in contact met lucht (National Center for Biotechnology Information., 2017). Het uiterlijk wordt getoond in figuur 2.

De verbinding heeft een molecuulgewicht van 128,91 g / mol en ontleedt bij 100 ° C en heeft een pKa van -2. Omdat het een onstabiele verbinding is, werden de fysisch-chemische eigenschappen ervan verkregen door rekenkundige berekeningen..
Het heeft een smeltpunt van 206,04 ° C, een kookpunt van 517,26 ° C en een oplosbaarheid in water van 1 x 106 mg / l bij 25 ° C (Royal Society of Chemistry, 2015).
De verbinding is een sterk oxidatiemiddel. Wanneer het wordt gemengd met ethanol of ether, ontleedt het om azijnzuur te vormen in een exotherme reactie. Het is essentieel voor de bereiding van bromaatzouten (BrO3-) die worden bereid door carbonaten of metaaloxiden te laten reageren met broomzuur (Watts, 1870).
Reactiviteit en gevaren
Broomzuur is een onstabiele verbinding die ontleedt tot elementair broom. Omdat het een sterk zuur is, is het buitengewoon gevaarlijk bij contact met de huid (bijtend en irriterend), bij contact met de ogen (irriterend) en bij inslikken. Zeer gevaarlijk ook bij inademing.
Ernstige overmatige blootstelling kan longschade, verstikking, bewustzijnsverlies of de dood veroorzaken. Langdurige blootstelling kan brandwonden en zweren op de huid veroorzaken. Overmatige blootstelling door inademing kan irritatie van de luchtwegen veroorzaken..
Ontsteking van het oog wordt gekenmerkt door roodheid, tranen en jeuk. Ontsteking van de huid wordt gekenmerkt door jeuk, schilfering, roodheid en soms blaarvorming.
De stof is giftig voor de nieren, longen en slijmvliezen. Herhaalde of langdurige blootstelling aan de stof kan schade aan deze organen veroorzaken..
In geval van contact met de ogen
Controleer of er contactlenzen worden gedragen en verwijder ze onmiddellijk. De ogen moeten gedurende ten minste 15 minuten met stromend water worden gespoeld, waarbij de oogleden open moeten blijven. Koud water kan worden gebruikt. Oogzalf mag niet worden gebruikt.
Bij huidcontact
Als de chemische stof in contact komt met kleding, moet u deze zo snel mogelijk verwijderen en daarbij uw eigen handen en lichaam beschermen. Plaats het slachtoffer onder een veiligheidsdouche.
Als de chemische stof zich ophoopt op de blootgestelde huid van het slachtoffer, zoals de handen, wordt de besmette huid voorzichtig en voorzichtig gewassen met stromend water en niet-schurende zeep. Koud water kan worden gebruikt. Roep medische hulp in als de irritatie aanhoudt. Was de besmette kleding voordat u deze opnieuw gebruikt.
Als het contact met de huid ernstig is, moet deze worden gewassen met een desinfecterende zeep en de besmette huid bedekken met een antibacteriële crème..
Bij inademing
Het is raadzaam om het slachtoffer te laten rusten in een goed geventileerde ruimte. Als de inademing ernstig is, moet het slachtoffer zo snel mogelijk naar een veilige plaats worden geëvacueerd. Maak strak zittende kleding los, zoals een overhemdkraag, riem of stropdas. Als het slachtoffer moeite heeft met ademen, moet zuurstof worden toegediend.
Als het slachtoffer niet ademt, wordt mond-op-mondbeademing uitgevoerd. Houd er altijd rekening mee dat het gevaarlijk kan zijn voor de persoon die hulp verleent om mond-op-mondbeademing te geven wanneer het ingeademde materiaal giftig, besmettelijk of bijtend is..
Bij inslikken geen braken opwekken. Maak strak zittende kleding los, zoals kragen, riemen of stropdassen. Voer mond-op-mondbeademing uit als het slachtoffer niet ademt.
Zoek in alle gevallen onmiddellijk medische hulp..
Toepassingen
Broomzuur wordt gebruikt als een krachtig oxidatiemiddel in laboratoriumreacties. Het wordt gebruikt om chemische verbindingen te produceren zoals onder andere jodaten, chloorzuur, tetraihonzuur..
Het wordt ook gebruikt voor de productie van bromaten zoals onder andere ijzer, lood, mangaan en kwikbromaat..
Broomzuur fungeert als een belangrijk tussenproduct in de Bélousov-Zhabotinsky-reactie (Morris, 2010). Deze reactie is een voorbeeld van chemische klokken en illustreert een thermodynamische niet-evenwichtsreactie.
De oscillatiereactie wordt gekatalyseerd door cerium en is inherent verbonden met de chemie van broomoxozuren HBrOx. De groeiende belangstelling voor niet-lineaire chemische systemen heeft geleid tot sterke prikkels om de chemie van broom te bestuderen..
In de Belousov-Zhabotinsky-reactie zijn de betrokken broomverbindingen hypobroomzuur HOBr, broomzuur HOBrO en broomzuur HBrO3 (3) (Rainer Glaser, 2013).
Dit soort reacties zijn belangrijk voor theoretische chemie. Ze laten zien dat chemische reacties niet gedomineerd hoeven te worden door thermodynamisch evenwichtsgedrag.
Referenties
- Broomzuur. (S.F.). Opgehaald van chemyq.com.
- EMBL-EBI. (2008, 16 mei). broomzuur. Hersteld van ebi.ac.uk.
- EMBL-EBI. (2014, 28 juli). chloorzuur. Hersteld van ebi.ac.uk.
- Morris, S. (2010, 23 januari). Belousov Zhabotinsky-reactie 8 x normale snelheid. Opgehaald van youtubecom.
- Mijn favoriete chemicaliën. (S.F.). Opgehaald van bromicacid.com.
- Nationaal centrum voor informatie over biotechnologie. (2017, 11 maart). PubChem samengestelde database; CID = 24445 ,. Opgehaald van PubChem.
- Rainer Glaser, M. D. (2013). Waarom de zuurgraad van broomzuur echt van belang is voor kinetische modellen van Belousov-Zhabotinsky oscillerende chemische reacties. Journal of Thermodynamics & Catalysis 4: 1.
- Royal Society of Chemistry. (2015). Broomzuur. Opgehaald van chemspider.com.
- Watts, H. (1870). A Dictionary of Chemistry and Allied Branches of Other Sciences, Volume 1. London: longmans, green and co.



Niemand heeft nog op dit artikel gereageerd.