
Formule, eigenschappen en toepassingen van chloorzuur (HClO2)

De chloorzuur is een anorganische verbinding met de formule HClOtwee. Dit zuur is een van de oxzuurzuren van chloor waar het zich in oxidatietoestand bevindt 3+. Hoewel het zuur in zijn zuivere substantie moeilijk te verkrijgen is, is de geconjugeerde base die van deze zuren wordt afgeleid, het chlorietion, stabiel..
Een voorbeeld van een zout van dit anion is het bekende natriumchloriet. Deze en aanverwante zouten worden soms gebruikt bij de productie van chloordioxide..
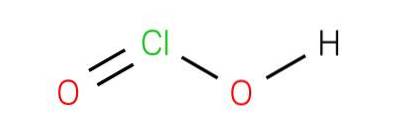
Chloorzuur is een zwak zuur. De zuivere stof is onstabiel, niet in verhouding tot hypochloorzuur (Cl +1 oxidatietoestand) en chloorzuur (Cl +5 oxidatietoestand):
2HClOtwee → HClO + HClO3
Chloorzuur wordt samen met chloorzuur verkregen bij de ontleding van de waterige oplossing van chloordioxide.
De chloorzuuroplossing werd voor het eerst verkregen door chloorzuur te reduceren met wijnsteenzuur (A. J. Downs, 1973), maar de belangrijkste methode om dit zuur te verkrijgen is door een suspensie van bariumchloride te behandelen met zwavelzuur:
Ba (ClOtweetwee + H.tweeSW4 → BaSO4 + 2HClOtwee
Chloorzuur is een krachtig oxidatiemiddel, hoewel de neiging tot disproportionering of disproportie het oxidatiepotentieel tegengaat..
Chloor is het enige halogeen dat een isoleerbaar zuur vormt met formule HXOtwee. Noch broomzuur, noch jodiumzuur zijn geïsoleerd. Sommige zouten van broomzuur, bromiet, zijn bekend, maar behalve als tussenproducten in reacties, zijn er geen jodietzouten..
Artikel index
- 1 Fysische en chemische eigenschappen
- 2 Reactiviteit en gevaren
- 3 toepassingen
- 4 referenties
Fysische en chemische eigenschappen
Chloorzuur, indien geïsoleerd, is een kleurloze vloeistof zonder een karakteristiek aroma (National Center for Biotechnology Information, 2017).
De verbinding heeft een molecuulgewicht van 68,456 g / mol. Het heeft een kookpunt (berekend) van 502,07 ° C en een oplosbaarheid in water (berekend) van 1 × 106 mg / l (Royal Society of Chemistry, 2015).
HClOtwee het is onstabiel als gevolg van de dismutatie- (of disproportionerings-) reactie om chloor- en hypochloorzuur te produceren (C. C. Hong, 1968) vergelijkbaar met die van de analoge broom- en jodiumzuren:
2HClOtwee → HClO + HClO3
Chloorzuur wordt als een zwak zuur beschouwd, hoewel de dissociatieconstante in de orde van grootte van 1 x 10 ligt-twee waardoor het niet zo zwak is als andere zuren met een pKa van 1,96.
Reactiviteit en gevaren
Chloorzuur is een onstabiele verbinding en een sterk oxidatiemiddel dat onverenigbaar is met reductiemiddelen en basen..
Chloorzuur irriteert bij contact met huid en ogen en is gevaarlijk bij inslikken en inademen.
Controleer in geval van contact met de ogen of u contactlenzen draagt en verwijder deze onmiddellijk. Ogen moeten gedurende minstens 15 minuten met stromend water worden gespoeld, waarbij de oogleden open moeten blijven. Koud water kan worden gebruikt. Oogzalf mag niet worden gebruikt.
Als de chemische stof in contact komt met kleding, moet u deze zo snel mogelijk verwijderen en daarbij uw eigen handen en lichaam beschermen. Plaats het slachtoffer onder een veiligheidsdouche.
Als de chemische stof zich ophoopt op de blootgestelde huid van het slachtoffer, zoals de handen, wordt de besmette huid voorzichtig en voorzichtig gewassen met stromend water en niet-schurende zeep..
Koud water kan worden gebruikt. Roep medische hulp in als de irritatie aanhoudt. Was de besmette kleding voordat u deze opnieuw gebruikt.
Als het contact met de huid ernstig is, moet deze worden gewassen met een desinfecterende zeep en de besmette huid bedekken met een antibacteriële crème..
Bij inademing moet het slachtoffer rusten in een goed geventileerde ruimte. Als de inademing ernstig is, moet het slachtoffer zo snel mogelijk naar een veilige plaats worden geëvacueerd. Maak strak zittende kleding los, zoals een overhemdkraag, riem of stropdas.
Als het slachtoffer moeite heeft met ademen, moet zuurstof worden toegediend. Als het slachtoffer niet ademt, wordt mond-op-mondbeademing uitgevoerd. Houd er altijd rekening mee dat het gevaarlijk kan zijn voor de persoon die hulp verleent om mond-op-mondbeademing te geven wanneer het ingeademde materiaal giftig, besmettelijk of bijtend is..
Bij inslikken geen braken opwekken. Maak strak zittende kleding los, zoals kragen, riemen of stropdassen. Voer mond-op-mondbeademing uit als het slachtoffer niet ademt. Zoek in alle gevallen onmiddellijk medische hulp..
Toepassingen
Er zijn onderzoeken uitgevoerd waarbij meta-stabiele chloorzuur / chlooroxide-oplossingen worden gebruikt als mondwater voor het verminderen van tandplak (Goultschin J, 1989).
De studie werd uitgevoerd op een groep van 18 vrijwilligers in de leeftijd van 20-27 jaar. Het effect ervan op de ontwikkeling van tandplak en het aantal bacteriën in het speeksel werd getest, waarbij een vermindering tot 34,5% van de scores op tandplak werd verkregen in vergelijking met een placebogroep..
Chloorzuur is betrokken bij de bereiding van natriumzuurchloriet dat antimicrobiële eigenschappen heeft en is bedoeld om voornamelijk te worden gebruikt als een spray- of dompeloplossing voor gevogelte, vlees, groenten, fruit en zeevruchten. Ook gebruikt in koelwater voor pluimvee.
Natriumzuurchloriet wordt geproduceerd door een zuur van voedingskwaliteit (bijvoorbeeld citroenzuur, fosforzuur, zoutzuur, appelzuur of natriumwaterstofsulfaat) toe te voegen aan een waterige oplossing van natriumchloriet (NaClOtwee.
De combinatie van het zuur met de natriumchlorietoplossing resulteert in de omzetting van chloriet in metastabiel chloorzuur (HClOtwee.
NaClOtwee + H.+ ⇌ HClOtwee + Na+
Deze oplossing kan later een mengsel vormen met chloriet (ClOtwee-), chloordioxide (ClOtwee) en chloride (Cl¯). De reactie genereert een oxidatieve oplossing met oxychloorverbindingen met antimicrobiële eigenschappen.
Natriumzuurchloriet is ontworpen om te worden gebruikt als onderdeel van een geïntegreerde aanpak om microbiële ladingen in voedsel te beheersen.
Natriumzuurchlorietoplossing werkt om het aantal pathogenen te verminderen (bijvoorbeeld Escherichia coli, E. coli O157: H7, Salmonella spp., Campylobacter spp., En Listeria monocytogenes) (Rao, 2006).
Referenties
- J. Downs, C. J. (1973). De chemie van chloor, broom, jodium en astatine: Pergamon…, deel 7. New York: Pergamon-pers.
- C. Hong, W. H. (1968). Kinetiek van disproportionering van chloorzuur. Canadian Journal of Chemistry 46 (12): , 2053-2060. nrcresearchpress.com.
- EMBL-EBI. (2014, 28 juli). chloorzuur. Opgehaald van ChEBI: ebi.ac.uk.
- Goultschin J, G. J. (1989). Gebruik van een gemetastabiliseerde formulering van chloorzuur / chloordioxide als mondspoeling voor het verminderen van tandplak. Isr J Dent Sci.2 (3), 142-147. ncbi.nlm.nih.gov.
- Nationaal centrum voor informatie over biotechnologie ... (2017, 30 april). PubChem samengestelde database CID = 24453. Opgehaald van PubChem.
- Rao, M. V. (2006, december). GEZUURDE NATRIUMCHLORIET (ASC) Chemische en technische beoordeling. Opgehaald van fao.org.
- Royal Society of Chemistry. (2015). Chloorzuur. Opgehaald van chemspider.com.


Niemand heeft nog op dit artikel gereageerd.