
Chloorzuur (HClO3) formule, eigenschappen, gebruik
De chloorzuur is een anorganische verbinding met de formule HClO3, samengesteld uit een oxacid zuur waarin chloor een oxidatietoestand +5 heeft met een structuur analoog aan broomzuur of joodzuur. Het is een sterk zuur dat waterstof kan afgeven aan een acceptor of Bronsted-base..
Zuur werd voor het eerst ontdekt in de 17e eeuw, door Johann Rudolf Glauber uit Karlstadt am Main, Duitsland, waarin hij natriumchloride en zwavelzuur gebruikte voor de bereiding van natriumsulfaat in het Mannheim-proces, waarbij chloorgas uit waterstof vrijkwam, schadelijk voor de mens.
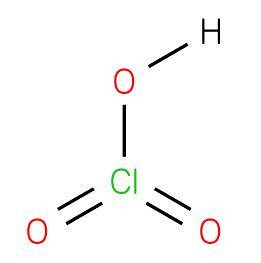
De verbinding wordt verkregen met bariumchloraat (barietchloraat) met zwavelzuur om bariumsulfaat (Jacob Green, 1829) te produceren dat onoplosbaar is in water volgens de volgende reactie:
Ba (ClO3twee + H.tweeSW4 → 2HClO3 + Baso4
Een andere methode om te verkrijgen is door hypochloorzuur te verwarmen om chloorzuur en waterstofchloride te verkrijgen volgens de reactie:
3HClO → HClO3 + 2HCl
Chloorzuur (HClO3) is een krachtig oxidatiemiddel omdat het kan worden gereduceerd tot oxidatietoestanden +3, +1 en -1. Het wordt gebruikt voor de vervaardiging van chloraatzouten.
Het ontleedt in concentraties van meer dan 30%. Het ontleedt ook bij verhitting, daarom moet het de hele tijd koud worden gehouden en moeten alle glazen potten die voor het hanteren worden gebruikt, vooraf worden gekoeld..
Artikel index
- 1 Fysische en chemische eigenschappen
- 1.1 Zelfreactief
- 2 Reactiviteit en gevaren
- 3 toepassingen
- 4 referenties
Fysische en chemische eigenschappen
Chloorzuur bestaat alleen in oplossing. Het is een kleurloze vloeistof zonder een karakteristiek aroma (National Center for Biotechnology Information, 2017), het uiterlijk is weergegeven in figuur 2.

De verbinding heeft een molecuulgewicht van 84,459 g / mol en een dichtheid van 1 g / ml bij ongeveer 25 ° C. Het heeft een kookpunt hoger dan 100 ° C (CHLORIC ACID, S.F.) en een oplosbaarheid in water van 40 g per 100 ml van dit oplosmiddel bij 25 ° C (Royal Society of Chemistry, 2015).
Chloorzuur versnelt de verbranding van brandbare materialen en kan bij contact het meest ontbranden. De verbinding is bijtend voor metalen en weefsels.
Zelfreactief
- Chloorzuurconcentraties boven 40% worden afgebroken.
- Antimoonsulfide- en geconcentreerde chloorzuuroplossingen reageren met gloeien.
- Arseensulfide en geconcentreerde chloorzuuroplossingen reageren met gloeien.
- Reageert heftig, explodeert zelfs met andere metaalsulfiden, zoals kopersulfide.
- In contact met oxideerbare materialen, waaronder ammoniak, kunnen reacties extreem heftig zijn..
- Het filtreerpapier licht op na onderdompeling in zoutzuur.
- De explosies zijn geregistreerd door mengsels van chloorzuuroplossing met metalen zoals: antimoon, bismut en ijzer. Dit komt door de vorming van explosieve verbindingen, waaronder waterstof (CHLORIC ACID, 2016).
Reactiviteit en gevaren
Chloorzuur is een onstabiele verbinding. Omdat het een sterk zuur is, is het buitengewoon gevaarlijk in geval van contact met de huid (het is bijtend en irriterend), bij contact met de ogen (irriterend) en bij inslikken. Ook erg gevaarlijk bij inademing.
Ernstige overmatige blootstelling kan longschade, verstikking, bewustzijnsverlies of de dood veroorzaken. Langdurige blootstelling kan brandwonden en zweren op de huid veroorzaken.
Overmatige blootstelling door inademing kan irritatie van de luchtwegen veroorzaken. Ontsteking van het oog wordt gekenmerkt door roodheid, tranen en jeuk. Ontsteking van de huid wordt gekenmerkt door jeuk, schilfering, roodheid en soms blaarvorming.
De stof is giftig voor de nieren, longen en slijmvliezen. Herhaalde of langdurige blootstelling aan de stof kan schade aan deze organen veroorzaken..
Controleer in geval van contact met de ogen of u contactlenzen draagt en verwijder deze onmiddellijk. Ogen moeten gedurende minstens 15 minuten met stromend water worden gespoeld, waarbij de oogleden open moeten blijven. Koud water kan worden gebruikt. Oogzalf mag niet worden gebruikt.
Als de chemische stof in contact komt met kleding, moet u deze zo snel mogelijk verwijderen en daarbij uw eigen handen en lichaam beschermen. Plaats het slachtoffer onder een veiligheidsdouche.
Als de chemische stof zich ophoopt op de blootgestelde huid van het slachtoffer, zoals de handen, wordt de besmette huid voorzichtig en voorzichtig gewassen met stromend water en niet-schurende zeep..
Het zuur kan ook worden geneutraliseerd met verdund natriumhydroxide of een zwakke base zoals zuiveringszout. Roep medische hulp in als de irritatie aanhoudt. Was de besmette kleding voordat u deze opnieuw gebruikt.
Als het contact met de huid ernstig is, moet deze worden gewassen met een desinfecterende zeep en de besmette huid bedekken met een antibacteriële crème..
Bij inademing moet het slachtoffer rusten in een goed geventileerde ruimte. Als de inademing ernstig is, moet het slachtoffer zo snel mogelijk naar een veilige plaats worden geëvacueerd..
Maak strak zittende kleding los, zoals een overhemdkraag, riem of stropdas. Als het slachtoffer moeite heeft met ademen, moet zuurstof worden toegediend. Als het slachtoffer niet ademt, wordt mond-op-mondbeademing uitgevoerd.
Houd er altijd rekening mee dat het gevaarlijk kan zijn voor degene die hulp verleent bij het geven van mond-op-mondbeademing, wanneer het ingeademde materiaal giftig, besmettelijk of bijtend is.
Bij inslikken geen braken opwekken. Maak strak zittende kleding los, zoals kragen, riemen of stropdassen. Voer mond-op-mondbeademing uit als het slachtoffer niet ademt. Zoek in alle gevallen onmiddellijk medische hulp..
Toepassingen
Chloorzuur wordt voornamelijk gebruikt voor de vorming van chloraatzouten zoals: natrium-, calcium-, magnesium-, strontium-, lood-, koper- en zilverchloraat evenals protochloor en kwikperchloraat worden bereid met chloorzuur als reagens..
Stabiele voorloper van chloordioxide, het wordt gebruikt bij de elektrochemische productie van zeer zuiver ammoniumperchloraat (Dotson, 1993).
De belangrijkste productie van chloorzuur begon tijdens de industriële revolutie in Europa en werd gebruikt om vinylchloride te maken voor PVC-buizen.
Een ander gebruik voor zuur zijn tal van kleinschalige toepassingen, waaronder huishoudelijke reiniging, productie van gelatine en andere levensmiddelenadditieven, ontkalken en leerverwerking (chloorzuur, S.F.).
Referenties
- CHLOORZUUR. (2016). Hersteld van cameochemicaliën: cameochemicals.noaa.gov.
- chloorzuur. (S.F.). Hersteld van weebly: http://chloricacid.weebly.com/
- CHLOORZUUR. (S.F.). Opgehaald van chemicalbook: chemicalbook.com.
- Dotson, R. (1993). Een nieuw elektrochemisch proces voor de productie van ammoniumperchloraat. Journal of Applied Electrochemistry Volume 23, Issue 9,, 897-904. link.springer.com.
- EMBL-EBI. (2014, 28 juli). chloorzuur. Opgehaald van ebi.ac.uk: ebi.ac.uk.
- Jacob Green, E. T. (1829). Een tekstboek over chemische filosofie . Philadelphia: Russell & Martien.
- Nationaal centrum voor informatie over biotechnologie ... (2017, 15 april). PubChem samengestelde database; CID = 19654. Opgehaald van pubchem: .pubchem.ncbi.nlm.nih.gov.
- Royal Society of Chemistry. (2015). CHLOORZUUR. Opgehaald van chemspider: chemspider.com.



Niemand heeft nog op dit artikel gereageerd.