
Structuur, eigenschappen, toepassingen en risico's van fumaarzuur

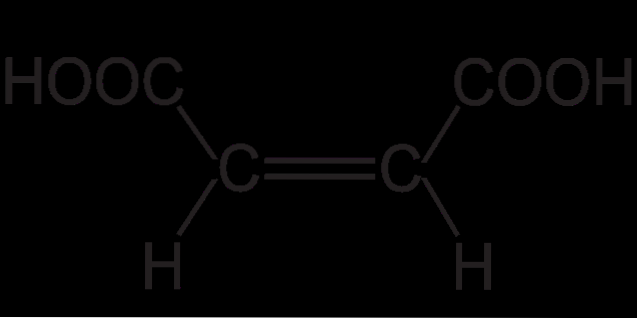
De fumaarzuur of trans-buteendizuur is een zwak dicarbonzuur dat ingrijpt in de Krebs-cyclus (of tricarbonzuurcyclus) en in de ureumcyclus. De moleculaire structuur is HOOCCH = CH COOH, waarvan de gecondenseerde molecuulformule C is4H.4OF4. De zouten en esters van fumaarzuur worden fumaraten genoemd.
Het wordt geproduceerd in de Krebs-cyclus uit succinaat dat wordt geoxideerd tot fumaraat door de werking van het enzym succinaat dehydrogenase, met behulp van FAD (Flavin Adenil Dinucleotide) als co-enzym. Terwijl FAD wordt teruggebracht tot FADHtwee. Vervolgens wordt het fumaraat gehydrateerd tot L-malaat door de werking van het enzym fumarase.
In de ureumcyclus wordt arginosuccinaat omgezet in fumaraat door de werking van het enzym arginosuccinaatlyase. Fumaraat wordt omgezet in malaat door cytosolische fumarase.
Fumaarzuur kan worden gemaakt uit glucose in een proces dat wordt gemedieerd door de schimmel Rhizopus nigricans. Fumaarzuur kan ook worden verkregen door de calorische isomerisatie van maleïnezuur. Het kan ook worden gesynthetiseerd door de oxidatie van furfural met natriumchloraat in aanwezigheid van vanadiumpentoxide..
Fumaarzuur heeft veel toepassingen; als voedingsadditief, harsproductie en bij de behandeling van bepaalde ziekten, zoals psoriasis en multiple sclerose. Het brengt echter lichte gezondheidsrisico's met zich mee waarmee rekening moet worden gehouden..
Artikel index
- 1 Chemische structuur
- 1.1 Geometrische isomerie
- 2 Fysische en chemische eigenschappen
- 2.1 Moleculaire formule
- 2.2 Molecuulgewicht
- 2.3 Fysiek uiterlijk
- 2.4 Geur
- 2.5 Smaak
- 2.6 Kookpunt
- 2.7 Smeltpunt
- 2.8 Vlampunt
- 2.9 Oplosbaarheid in water
- 2.10 Oplosbaarheid in andere vloeistoffen
- 2.11 Dichtheid
- 2.12 Dampspanning
- 2.13 Stabiliteit
- 2.14 Zelfontbranding
- 2.15 Verbrandingswarmte
- 2,16 pH
- 2.17 Ontleding
- 3 toepassingen
- 3.1 In eten
- 3.2 Bij de productie van harsen
- 3.3 In de geneeskunde
- 4 Risico's
- 5 referenties
Chemische structuur
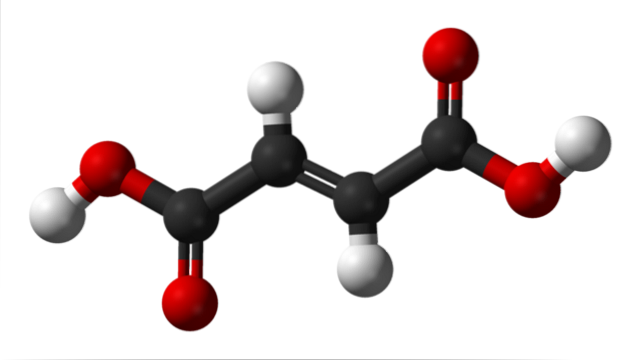
De bovenste afbeelding illustreert de moleculaire structuur van fumaarzuur. De zwarte bollen komen overeen met de koolstofatomen waaruit het hydrofobe skelet bestaat, terwijl de rode bollen tot de twee carboxylgroepen COOH behoren. Beide COOH-groepen worden dus alleen gescheiden door twee koolstofatomen die zijn verbonden door een dubbele binding, C = C.
De structuur van fumaarzuur heeft een lineaire geometrie. Dit komt doordat alle atomen van het carbonaatskelet sp-hybridisatie hebbentwee en daarom rusten ze in hetzelfde vlak naast de twee centrale waterstofatomen (de twee witte bollen, de ene naar boven en de andere naar beneden).
De enige twee atomen die uit dit vlak steken (en met weinig steile hoeken) zijn de twee zure protonen van de COOH-groepen (de witte bollen aan de zijkanten). Wanneer fumaarzuur volledig wordt gedeprotoneerd, verkrijgt het twee negatieve ladingen die aan de uiteinden resoneren, waardoor het een dibasisch anion wordt..
Geometrische isomerie
De structuur van fumaarzuur vertoont trans (of E) isomerie. Dit berust op de relatieve ruimtelijke posities van de substituenten op de dubbele binding. De twee kleine waterstofatomen wijzen in tegengestelde richting, evenals de twee COOH-groepen..
Dit geeft het fumaarzuur een "zigzaggend" skelet. Terwijl het voor zijn andere geometrische isomeer, cis (of Z), dat niets meer is dan maleïnezuur, een gebogen skelet heeft in de vorm van een "C". Deze kromming is het resultaat van de frontale ontmoeting van de twee COOH-groepen en de twee H-groepen in dezelfde oriëntaties:
Fysische en chemische eigenschappen
Moleculaire formule
C4H.4OF4.
Molecuulgewicht
116,072 g / mol.
Fysiek uiterlijk
Een kleurloze kristallijne vaste stof. De kristallen zijn naaldvormig monoklien.
Wit kristallijn poeder of korrels.
Geur
Toilet.
Smaak
Citrusvrucht.
Kookpunt
329 ° F bij een druk van 1,7 mmHg (522 ° C). Sublimeert bij 200 ° C (392 ° F) en ontleedt bij 287 ° C.
Smeltpunt
572 ° F tot 576 ° F (287 ° C).
Vlampunt
273º C (open glas). 230º C (gesloten beker).
Oplosbaarheid in water
7.000 mg / l bij 25ºC.
Oplosbaarheid in andere vloeistoffen
-Oplosbaar in ethanol en geconcentreerd zwavelzuur. Met ethanol kan het waterstofbruggen vormen en, in tegenstelling tot watermoleculen, hebben die van ethanol een grotere affiniteit met het organische skelet van zijn structuur..
-Slecht oplosbaar in ethylester en aceton.
Dichtheid
1.635 g / cm3 bij 68 ° F. 1.635 g / cm3 bij 20º C.
Dampdruk
1,54 x 10-4 mmHg bij 25º C.
Stabiliteit
Het is stabiel, hoewel het afbreekbaar is door aërobe en anaërobe micro-organismen.
Bij verhitting van fumaarzuur in een gesloten bak met water tussen 150º C en 170º C ontstaat DL-appelzuur..
Zelfontbranding
1.634 º F (375 º C).
Verbrandingswarmte
2760 cal / g.
pH
3.0-3.2 (0,05% oplossing bij 25 ° C). Deze waarde hangt af van de mate van dissociatie van de twee protonen, aangezien het een dicarbonzuur is en daarom diprotisch..
Ontleding
Het ontleedt bij verhitting en vormt een bijtend gas. Reageert hevig met sterk oxiderende stoffen, waarbij brandbare en giftige gassen ontstaan die brand en zelfs explosies kunnen veroorzaken.
Bij gedeeltelijke verbranding wordt fumaarzuur omgezet in het irriterende maleïnezuuranhydride..
Toepassingen
In eten
-Het wordt gebruikt als zuurteregelaar in voedsel en vervult een regulerende functie van de zuurgraad. Het kan voor dit doel ook wijnsteenzuur en citroenzuur vervangen. Bovendien wordt het gebruikt als conserveermiddel voor levensmiddelen.
-In de voedingsindustrie wordt fumaarzuur gebruikt als zuurmiddel, toegepast op frisdranken, westerse wijnen, koude dranken, vruchtensapconcentraten, ingeblikt fruit, augurken, ijsjes en frisdranken..
-Fumaarzuur wordt gebruikt in alledaagse dranken, zoals chocolademelk, advocaat, cacao en gecondenseerde melk. Fumaarzuur wordt ook aan kaas toegevoegd, inclusief smeltkaas en kaasvervangers..
-Desserts zoals pudding, gearomatiseerde yoghurt en sorbets kunnen fumaarzuur bevatten. Dit zuur kan eieren en desserts op basis van eieren, zoals custard, bewaren..
Extra toepassingen binnen de voedingsindustrie
-Fumaarzuur helpt voedsel te stabiliseren en op smaak te brengen. Spek en ingeblikt voedsel hebben ook deze verbinding toegevoegd.
-Het gecombineerd gebruik met benzoaten en boorzuur is nuttig tegen de afbraak van vlees, vis en schaaldieren.
-Het heeft antioxiderende eigenschappen, daarom is het gebruikt bij het conserveren van boter, kaas en melkpoeder..
-Vergemakkelijkt het hanteren van het bloemdeeg, waardoor het gemakkelijker kan worden verwerkt.
-Het is met succes gebruikt in de voeding van varkens in termen van gewichtstoename, verbetering van de spijsvertering en vermindering van pathogene bacteriën in het spijsverteringsstelsel..
Bij de productie van harsen
-Fumaarzuur wordt gebruikt bij de productie van onverzadigde polyesterharsen. Deze hars heeft een uitstekende weerstand tegen chemische corrosie en hittebestendigheid. Bovendien wordt het gebruikt bij de vervaardiging van alkydharsen, fenolharsen en elastomeren (rubbers).
-Fumaarzuur / vinylacetaatcopolymeer is een hoogwaardige vorm van lijm. Het copolymeer van fumaarzuur met styreen is een grondstof bij de vervaardiging van glasvezels.
-Het is gebruikt voor de productie van meerwaardige alcoholen en als bijtmiddel van kleurstoffen.
In de geneeskunde
-Natriumfumaraat kan reageren met ferrosulfaat om de ijzerfumaraatgel te vormen, waardoor het medicijn onder de naam Fersamal ontstaat. Dit wordt ook gebruikt bij de behandeling van bloedarmoede bij kinderen.
-Dimethylfumaraatester is gebruikt bij de behandeling van multiple sclerose, waardoor de progressie van invaliditeit wordt verminderd.
-Bij de behandeling van psoriasis zijn verschillende esters van fumaarzuur gebruikt. Fumaarzuurverbindingen zouden hun therapeutische werking uitoefenen door hun immuunmodulerende en immuunonderdrukkende vermogen..
-De plant Fumaria officinalis bevat van nature fumaarzuur en wordt al decennia gebruikt bij de behandeling van psoriasis.
Nierfalen, verminderde leverfunctie, gastro-intestinale effecten en blozen zijn echter waargenomen bij een patiënt die voor psoriasis met fumaarzuur werd behandeld. De aandoening werd gediagnosticeerd als acute tubulaire necrosie.
Experimenten met deze verbinding
-In een experiment waarbij mensen gedurende één jaar 8 mg fumaarzuur / dag kregen toegediend, vertoonde geen van de deelnemers leverschade.
-Fumaarzuur is gebruikt om door thiocetamide geïnduceerde levertumoren bij muizen te remmen..
-Het is gebruikt bij muizen die zijn behandeld met mitomycine C. Dit medicijn veroorzaakt leverafwijkingen, bestaande uit verschillende cytologische veranderingen, zoals perinucleaire onregelmatigheid, chromatine-aggregatie en abnormale cytoplasmatische organellen. Ook fumaarzuur vermindert de incidentie van deze veranderingen.
-In experimenten met ratten heeft fumaarzuur een remmend vermogen getoond voor de ontwikkeling van slokdarmpapilloom, cerebrale glioom en bij mesenchymale tumoren van de nier..
-Er zijn experimenten die een tegengesteld effect van fumaarzuur laten zien in relatie tot kankertumoren. Het is onlangs geïdentificeerd als een oncometaboliet of endogene metaboliet die kanker kan veroorzaken. Er zijn hoge concentraties fumaarzuur in tumoren en in de vloeistof rond de tumor.
Risico's
-In contact met de ogen kan fumaarzuurpoeder irritatie veroorzaken, wat zich uit in roodheid, tranen en pijn.
-Bij contact met de huid kan het irritatie en roodheid veroorzaken.
-Inademing kan het slijmvlies van de neusholtes, het strottenhoofd en de keel irriteren. Het kan ook hoesten of kortademigheid veroorzaken..
-Aan de andere kant vertoont fumaarzuur geen toxiciteit bij inslikken..
Referenties
- Steven A.Hardinger. (2017). Geïllustreerde verklarende woordenlijst van organische chemie: fumaarzuur. Genomen uit: chem.ucla.edu
- Transmerquim Group. (Augustus 2014). Fumaarzuur. [Pdf]. Genomen van: gtm.net
- Wikipedia. (2018). Fumaarzuur. Genomen uit: en.wikipedia.org/wiki/Fumaric_acid
- PubChem. (2018). Fumaarzuur. Genomen uit: pubchem.ncbi.nlm.nih.gov
- Royal Society of Chemistry. (2015). Fumaarzuur. Genomen uit: chemspider.com
- ChemicalBook. (2017). Fumaarzuur. Genomen uit: chemicalbook.com



Niemand heeft nog op dit artikel gereageerd.