
Hyposulfurous Acid-formules, kenmerken en toepassingen
De onderzwavelig zuur of dithionous zuur is onbekend, onstabiel in zuivere vorm, heeft geen onafhankelijk bestaan en is niet gedetecteerd in waterige oplossing.
Theoretisch zou het een relatief zwak zuur zijn, vergelijkbaar met zwavelig zuur, H2SO3. Alleen de zouten ervan zijn bekend, de dithionieten, die stabiele en krachtige reductiemiddelen zijn. Het natriumzout van dithionzuur is natriumdithioniet.

- Formules
| dithionous zuur | dithioniet anion | natriumdithioniet | |
| Formules | H2S2O4 | S2O42− | Na2S2O4 |
- CAS: 20196-46-7 hyposulfurous (of dithionous) zuur
- CAS: 14844-07-6 onderzwavelig zuur (of dithionous, ion)
- CAS: 7775-14-6 natriumdithioniet (natriumzout van dithionzuur)
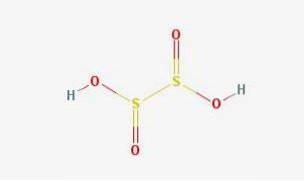
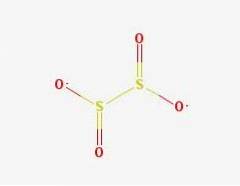
2D-structuur
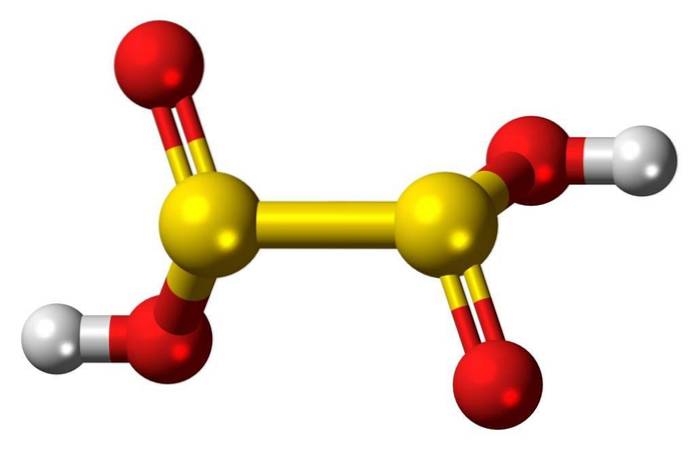
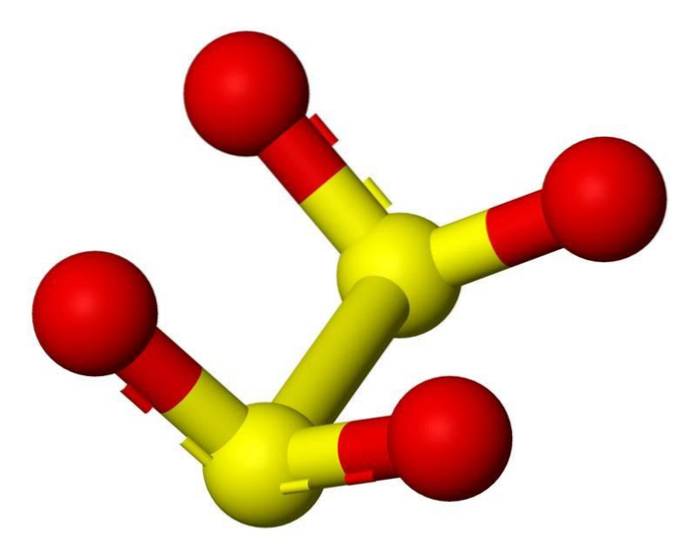
3D-structuur
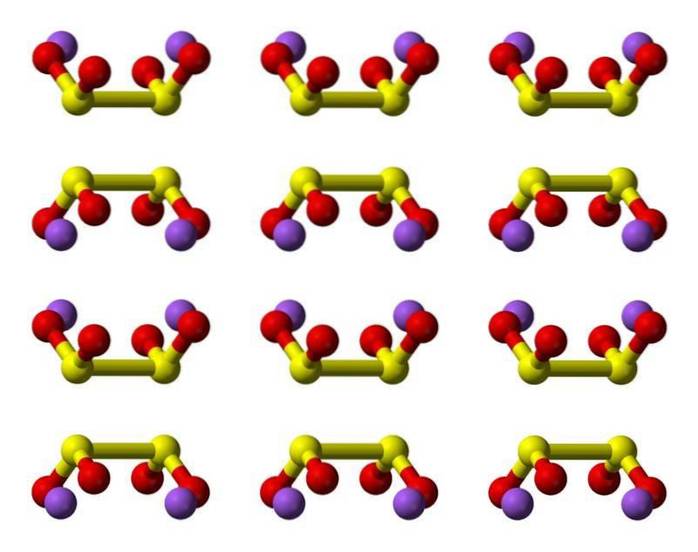
Kenmerken
Fysische en chemische eigenschappen
| dithionous zuur | dithioniet anion | natriumdithioniet | |
| Uiterlijk: | . | . | Wit tot gebroken wit kristallijn poeder |
| . | . | Lichte citroenschilfers | |
| Geur: | . | . | Vage zwavelgeur |
| Molecuulgewicht: | 130,132 g / mol | 128,116 g / mol | 174,096 g / mol |
| Kookpunt: | . | . | Het valt uiteen |
| Smeltpunt: | . | . | 52 ° C |
| Dichtheid: | . | . | 2,38 g / cm3 (watervrij) |
| Oplosbaarheid in water | . | . | 18,2 g / 100 ml (watervrij, 20 ° C) |
Onderzwavelig zuur is een zwaveloxozuur met de chemische formule H2S2O4.
Zwaveloxozuren zijn chemische verbindingen die zwavel, zuurstof en waterstof bevatten. Sommigen van hen zijn echter alleen bekend van hun zouten (zoals onderzwavelig zuur, dithionzuur, disulfidezuur en zwaveligzuur).
Onder de structurele kenmerken van de oxozuren die zijn gekarakteriseerd, hebben we:
- Tetraëdrische zwavel indien gecoördineerd met zuurstof
- Brug- en terminale zuurstofatomen
- Terminal peroxo-groepen
- S = S-aansluitingen
- Snaren van (-S-) n
Zwavelzuur is het bekendste zwaveloxozuur en industrieel het belangrijkste.
Het dithionietanion ([S2O4] 2-) is een oxoanion (een ion met de generieke formule AXOY z-) van zwavel dat formeel is afgeleid van dithionzuur.
Dithionietionen ondergaan zowel zure als alkalische hydrolyse tot respectievelijk thiosulfaat en bisulfiet en sulfiet en sulfide:
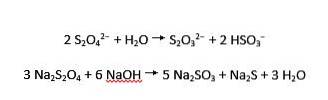
Het natriumzout van dithionzuur is natriumdithioniet (ook bekend als natriumhydrosulfiet).
Natriumdithioniet is een witachtig tot lichtgeel kristallijn poeder met een geur die lijkt op zwaveldioxide..
Het warmt spontaan op bij contact met lucht en vochtigheid. Deze warmte kan voldoende zijn om de omringende brandbare materialen te ontsteken..
Bij langdurige blootstelling aan vuur of intense hitte kunnen containers van dit materiaal heftig scheuren..
Het wordt gebruikt als reductiemiddel en als bleekmiddel. Het wordt gebruikt en voor het bleken van papierpulp en bij het verven. Het wordt ook gebruikt om de nitrogroep in organische reacties tot een aminogroep te reduceren..
Hoewel het onder de meeste omstandigheden stabiel is, valt het uiteen in heet water en zure oplossingen.
Het kan worden verkregen uit natriumbisulfiet door de volgende reactie:
2 NaHSO3 + Zn → Na2S2O4 + Zn (OH) ²
Lucht- en waterreacties
Natriumdithioniet is een brandbare vaste stof die langzaam ontleedt bij contact met water of waterdamp, waarbij thiosulfaten en bisulfieten worden gevormd..
Deze reactie produceert warmte, die de reactie verder kan versnellen of ervoor kan zorgen dat omringende materialen verbranden. Als het mengsel wordt opgesloten, kan de ontledingsreactie resulteren in het onder druk zetten van de houder, die krachtig kan scheuren. Terwijl het in de lucht blijft, oxideert het langzaam, waardoor giftige zwaveldioxidegassen vrijkomen.
Brandgevaar
Natriumdithioniet is een brandbaar en brandbaar materiaal. Kan ontbranden bij contact met vochtige lucht of vocht. Het kan snel branden met flare-effect. Kan heftig of explosief reageren in contact met water.
Kan explosief ontleden bij verhitting of bij brand. Het kan opnieuw worden ontstoken nadat het vuur is gedoofd. Afvloeiing kan brand- of explosiegevaar opleveren. Containers kunnen bij verhitting ontploffen.
Gezondheidsrisico
Bij contact met vuur zal Sodium Dithionite irriterende, corrosieve en / of giftige gassen produceren. Inademing van afbraakproducten kan ernstig letsel of de dood tot gevolg hebben. Contact met de stof kan ernstige brandwonden aan huid en ogen veroorzaken. Afvloeiing van vuurleiding kan vervuiling veroorzaken.
Toepassingen
Het dithionietion wordt gebruikt, vaak in combinatie met een complexvormer (bijv. Citroenzuur), om ijzer (III) oxyhydroxide te reduceren tot oplosbare ijzer (II) verbindingen en om amorfe ijzerhoudende minerale fasen (III) te verwijderen bij bodemanalyse (selectieve extractie ).
Dithioniet verhoogt de oplosbaarheid van ijzer. Dankzij de sterke affiniteit van het dithionietion voor bivalente en driewaardige metaalkationen, wordt het gebruikt als chelaatvormer..
De ontleding van dithioniet produceert gereduceerde zwavel soorten die zeer agressief kunnen zijn voor de corrosie van staal en roestvrij staal..
Onder de toepassingen van natriumdithioniet hebben we:
In de industrie
Deze verbinding is een in water oplosbaar zout en kan worden gebruikt als reductiemiddel in waterige oplossingen. Het wordt als zodanig gebruikt in sommige industriële verfprocessen, voornamelijk die met zwavelkleurstoffen en kuipkleurstoffen, waarbij een in water onoplosbare kleurstof kan worden gereduceerd tot een in water oplosbaar alkalimetaalzout (bijvoorbeeld de indigokleurstof).
De reducerende eigenschappen van natriumdithioniet verwijderen ook overtollige kleurstof, resterend oxide en ongewenste pigmenten, waardoor de algehele kleurkwaliteit wordt verbeterd..
Natriumdithioniet kan ook worden gebruikt voor waterbehandeling, gaszuivering, reiniging en extractie. Het kan ook in industriële processen worden gebruikt als sulfoneringsmiddel of als bron van natriumionen.
Naast de textielindustrie wordt deze verbinding gebruikt in industrieën die verband houden met leer, voeding, polymeren, fotografie en vele andere. Ook gebruikt als bleekmiddel bij organische reacties.
In de biologische wetenschappen
Natriumdithioniet wordt vaak gebruikt in fysiologische experimenten als middel om het redoxpotentieel van oplossingen te verminderen..
In geologische wetenschappen
Natriumdithioniet wordt vaak gebruikt in bodemchemie-experimenten om de hoeveelheid ijzer te bepalen die niet in primaire silicaatmineralen wordt opgenomen..
Veiligheid en risico's
Gevarenaanduidingen van het wereldwijd geharmoniseerde systeem voor de classificatie en etikettering van chemicaliën (GHS)
Het Globally Harmonized System of Classification and Labelling of Chemicals (GHS) is een internationaal overeengekomen systeem, gecreëerd door de Verenigde Naties en ontworpen om de verschillende classificatie- en etiketteringsnormen die in verschillende landen worden gebruikt te vervangen door wereldwijd consistente criteria te gebruiken..
De gevarenklassen (en hun overeenkomstige GHS-hoofdstuk), classificatie- en etiketteringsnormen en aanbevelingen voor natriumdithioniet zijn als volgt (European Chemicals Agency, 2017; United Nations, 2015; PubChem, 2017):



Referenties
- Benjah-bmm27, (2006). Een ball-and-stick-model van het dithioniet-ion [afbeelding] Hersteld van wikipedia.org.
- Drozdova, Y., Steudel, R., Hertwig, R. H., Koch, W., & Steiger, T. (1998). Structuren en energieën van verschillende isomeren van dithionzuur, H2S2O4, en van zijn anion HS2O4-1. The Journal of Physical Chemistry A, 102 (6), 990-996. Hersteld van: mycrandall.ca
- Europees Agentschap voor chemische stoffen (ECHA). (2017). Samenvatting van classificatie en etikettering. Geharmoniseerde classificatie - Bijlage VI van Verordening (EG) nr.1272 / 2008 (CLP-verordening). Natriumdithioniet, natriumhydrosulfiet. Opgehaald op 2 februari 2017, van: echa.europa.eu
- Jynto (gesprek), (2011). Dithionous-acid-3D-balls [afbeelding] Hersteld van: https://en.wikipedia.org/wiki/Dithionous_acid#/media/File:Dithionous-acid-3D-balls.png
- LHcheM, (2012). Voorbeeld van natriumdithioniet [afbeelding] Hersteld van: wikipedia.org.
- Mills, B. (2009). Sodium-dithionite-xtal-1992-3D-balls [afbeelding] Hersteld van: wikipedia.org.
- Verenigde Naties (2015). Wereldwijd geharmoniseerd systeem voor classificatie en etikettering van chemische stoffen (GHS) zesde herziene editie. New York, EU: publicatie van de Verenigde Naties. Hersteld van: unece.orgl
- Nationaal centrum voor informatie over biotechnologie. PubChem samengestelde database. (2017). Dithioniet. Bethesda, MD, EU: National Library of Medicine. Hersteld van: pubchem.ncbi.nlm.nih.gov.
- Nationaal centrum voor informatie over biotechnologie. PubChem samengestelde database. (2017). Dithionous zuur. Bethesda, MD, EU: National Library of Medicine. Hersteld van: nih.gov.
- Nationaal centrum voor informatie over biotechnologie. PubChem samengestelde database. (2017). Natriumdithioniet. Bethesda, MD, EU: National Library of Medicine. Hersteld van: nih.gov.
- Nationale Oceanic and Atmospheric Administration (NOAA). CAMEO Chemicals. (2017). Chemisch gegevensblad. Natriumdithioniet. Silver Spring, MD. EU; Hersteld van: cameochemicals.noaa.gov
- PubChem, (2016). Dithionite [afbeelding] Hersteld van: nih.gov.
- PubChem, (2016). Dithionite [afbeelding] Hersteld van: nih.gov.
- PubChem, (2016). Dithionous acid [image] Hersteld van: nih.gov.
- Wikipedia. (2017). Dithioniet. Opgehaald op 2 februari 2017, van: wikipedia.org.
- Wikipedia. (2017). Dithionous_acid. Opgehaald op 2 februari 2017, van: wikipedia.org.
- Wikipedia. (2017). Oxyanion. Opgehaald op 2 februari 2017, van: wikipedia.org.
- Wikipedia. (2017). Natriumdithioniet. Opgehaald op 2 februari 2017, van: wikipedia.org.
- Wikipedia. (2017). Zwaveloxozuur. Opgehaald op 2 februari 2017, van: wikipedia.org.



Niemand heeft nog op dit artikel gereageerd.