
Propaanzuur formule, eigenschappen, risico's en toepassingen

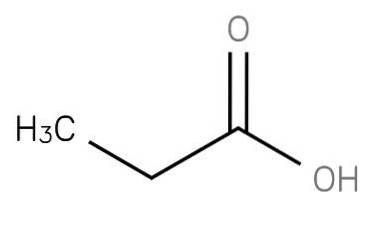
De propaanzuur is een verzadigd vetzuur met een korte keten dat ethaan omvat dat is gebonden aan het koolstofatoom van een carboxylgroep. De formule is CH3-CHtwee-COOH. Het CH3CH2COO-anion evenals de zouten en esters van propaanzuur staan bekend als propionaten (of propanoaten).
Het kan worden verkregen uit resten van houtpulp door fermentatieproces met bacteriën van het geslacht propionibacterium. Het wordt ook verkregen uit ethanol en koolmonoxide met behulp van een boortrifluoridekatalysator (O'Neil, 2001).
Een andere manier om propaanzuur te verkrijgen is door oxidatie van propionaldehyde in aanwezigheid van kobalt- of mangaanionen. Deze reactie verloopt snel bij temperaturen zo laag als 40-50 ° C:
2CH3CHtweeCHO + Otwee → 2CH3CHtweeCOOH
De verbinding is van nature in lage concentraties aanwezig in zuivelproducten en wordt in het algemeen samen met andere vetzuren met een korte keten geproduceerd in het maagdarmkanaal van mensen en andere zoogdieren als het eindproduct van microbiële koolhydraatvertering..
Heeft significante fysiologische activiteit bij dieren (Human Metabolome Database, 2017).
Artikel index
- 1 Fysische en chemische eigenschappen
- 2 Reactiviteit en gevaren
- 3 Biochemie
- 4 toepassingen
- 5 referenties
Fysische en chemische eigenschappen
Propaanzuur is een kleurloze, olieachtige vloeistof met een scherpe, onaangename, ranzige geur. Het uiterlijk is weergegeven in figuur 2 (National Center for Biotechnology Information, 2017).

Propaanzuur heeft een molecuulgewicht van 74,08 g / mol en een dichtheid van 0,992 g / ml. Het vriespunt en kookpunt zijn respectievelijk -20,5 ° C en 141,1 ° C. Propaanzuur is een zwak zuur waarvan de pKa 4,88 is.
De verbinding is zeer oplosbaar in water en kan 34,97 gram verbinding voor elke 100 ml oplosmiddel oplossen. Het is ook oplosbaar in ethanol, ether en chloroform (Royal Society of Chemistry, 2015).
Propaanzuur heeft fysische eigenschappen die liggen tussen die van de kleinere carbonzuren, mierenzuur en azijnzuur, en de grotere vetzuren..
Het toont de algemene eigenschappen van carbonzuren en kan amide-, ester-, anhydride- en chloridederivaten vormen. Het kan alfa-halogenering ondergaan met broom in aanwezigheid van PBr3 als katalysator (de HVZ-reactie) om CH3CHBrCOOH te vormen.
Reactiviteit en gevaren
Propaanzuur is een brandbaar en brandbaar materiaal. Het kan worden ontstoken door hitte, vonken of vlammen. Dampen kunnen explosieve mengsels vormen met lucht en kunnen zich naar de ontstekingsbron verplaatsen en ontploffen.
De meeste dampen zijn zwaarder dan lucht. Ze worden over de grond verspreid en verzameld in lage of besloten ruimtes (riolering, kelders, tanks). Gevaar voor dampexplosie binnen, buiten of in riolen.
Stoffen die zijn aangeduid met een (P), kunnen explosief polymeriseren wanneer ze worden verhit of worden overspoeld door vuur. Containers kunnen exploderen bij verhitting (PROPIONIC ACID, 2016).
De verbinding moet uit de buurt van hitte of ontstekingsbronnen worden gehouden. Bij verhitting tot ontbinding geeft het scherpe rook en irriterende dampen af.
Propaanzuur is irriterend voor de huid, ogen, neus en keel, maar veroorzaakt geen acute systemische effecten en heeft geen aantoonbaar genotoxisch potentieel. In geval van contact, wassen met veel water (Material Safety Data Sheet Propionic acid, 2013).
Biochemie
De geconjugeerde base van propaanzuur, propionaat, wordt gevormd als het terminale fragment van drie koolstofatomen (geactiveerd met co-enzym A als propionyl-CoA) bij de oxidatie van oneven koolstofvetzuren en zijketenoxidatie van cholesterol.
Experimenten met radioactieve isotopen van propionaat geïnjecteerd in nuchtere ratten geven aan dat het kan voorkomen in glycogeen, glucose, tussenproducten van de citroenzuurcyclus, aminozuren en eiwitten..
De route van het propaanzuurmetabolisme omvat interactie met co-enzym A, carboxylering om methylmalonyl-co-enzym A te vormen en omzetting in barnsteenzuur, dat de citroenzuurcyclus binnengaat..
Propaanzuur kan worden geoxideerd zonder ketonlichamen te vormen en wordt, in tegenstelling tot azijnzuur, zowel in een koolhydraat als in een lipide opgenomen (Bingham, Cohrssen, & Powell, 2001).
Propionzuuracidurie is een van de meest voorkomende organische acidurie, een ziekte die veel verschillende aandoeningen omvat.
Het resultaat van patiënten geboren met propionzuuracidurie vertoont een slecht intellectueel ontwikkelingspatroon, waarbij 60% een IQ van minder dan 75 heeft en speciaal onderwijs nodig heeft.
Succesvolle lever- en / of niertransplantaties bij enkele patiënten hebben geresulteerd in een verbeterde kwaliteit van leven, maar hebben niet noodzakelijk ingewanden en neurologische complicaties voorkomen.
Deze resultaten benadrukken de noodzaak van permanente metabolische monitoring, ongeacht de therapeutische strategie..
Toepassingen
Propaanzuur remt de groei van bacteriën en schimmels op niveaus tussen 0,1 en 1 gew.%. Als gevolg hiervan wordt het meeste geproduceerde propaanzuur geconsumeerd als conserveermiddel voor zowel voer als voedsel voor menselijke consumptie, zoals granen en granen..
De conservering van diervoeders, granen en voedsel naast de productie van calcium- en natriumpropionaten, wat goed is voor bijna 80% van de wereldwijde consumptie van propaanzuur in 2016, vergeleken met 78,5% in 2012.
Ongeveer 51% van de wereldwijde consumptie van propaanzuur is bestemd voor diervoeder en graanconservering, terwijl bijna 29% wordt gebruikt bij de productie van calcium- en natriumpropionaten, die ook worden gebruikt in de voedingsmiddelen- en diervoederindustrie..
Andere belangrijke markten voor propaanzuur zijn de productie van herbiciden en diethylketon. Toepassingen met een lager volume zijn onder meer het maken van celluloseacetaatpropionaat, farmaceutische producten, oplosmiddelesters, smaak- en geurstoffen, weekmakers, textiel-, leer- en rubberkleurstoffen en hulpstoffen.
De vraag naar propaanzuur is sterk afhankelijk van de productie van voer en granen, gevolgd door verpakte voedingsmiddelen en bakkerijproducten.
De wereldwijde groeivooruitzichten voor propaanzuur en zijn zouten in diervoeder / graan en voedselconservering zijn aanzienlijk (IHS Markit, 2016).
Andere snelgroeiende markten zijn onder meer propionaatesters voor oplosmiddelen, zoals n-butyl- en pentylpropionaat; Deze esters worden in toenemende mate gebruikt als vervanging voor oplosmiddelen die worden vermeld als gevaarlijke luchtverontreinigende stoffen..
Referenties
- Bingham, E., Cohrssen, B., en Powell, C. (2001). Patty's Toxicology Volumes 1-9 5e druk. New York: John Wiley & Sons.
- EMBL-EBI. (2016, 14 oktober). propionzuur. Opgehaald van ChEBI: ebi.ac.uk.
- Database met menselijke metabolieten. (2017, 2 maart). Propionzuur. Hersteld van hmdb.ca: hmdb.ca.
- IHS Markit. (2016, december). Chemical Economics Handbook Propionzuur. Hersteld van ihs: ihs.com.
- Veiligheidsinformatieblad Propionzuur. (2013, 21 mei). Opgehaald van sciencelab: sciencelab.com.
- Nationaal centrum voor informatie over biotechnologie ... (2017, 22 april). PubChem samengestelde database; CID = 1032. Opgehaald van pubchem.ncbi.nlm.nih.gov.
- O'Neil, M. (. (2001). The Merck Index - An Encyclopedia of Chemicals, Drugs, and Biologicals. 13e editie. New Jersey: Merck and Co., Inc..
- PROPIONZUUR. (2016). Hersteld van cameochemicaliën: cameochemicals.noaa.gov.
- Royal Society of Chemistry. (2015). Propionzuur. Opgehaald van chemspider: chemspider.com.



Niemand heeft nog op dit artikel gereageerd.