
Waterstofsulfide (H2S) structuur, eigenschappen, gebruik, belang

De waterstofsulfide of waterstofsulfide is een gas gevormd door de vereniging van een zwavelatoom (S) en twee waterstofatomen (H). De chemische formule is HtweeS. Ook bekend als waterstofsulfidegas. Het is een kleurloos gas waarvan de geur te zien is in rotte eieren.
Het is aanwezig in vulkanen en zwavelhoudende warmwaterbronnen, in aardgas en in ruwe olie. Het wordt ook gevormd tijdens de anaërobe afbraak (zonder zuurstof) van plantaardig en dierlijk organisch materiaal. Het komt van nature voor in het zoogdierlichaam, door de werking van bepaalde enzymen op cysteïne, een niet-essentieel aminozuur.
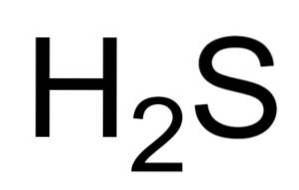
Waterige oplossingen van HtweeS zijn corrosief voor metalen zoals staal. De HtweeS is een reducerende verbinding die bij reactie met SOtwee , oxideert tot elementaire zwavel terwijl het wordt gereduceerd tot SOtwee ook zwavel.
Ondanks dat het een zeer giftige en dodelijke stof is voor mens en dier, wordt het belang ervan in een reeks belangrijke processen in het lichaam al enkele jaren bestudeerd..
Reguleert een reeks mechanismen die verband houden met het genereren van nieuwe bloedvaten en de werking van het hart.
Beschermt neuronen en wordt verondersteld in te werken tegen ziekten zoals Parkinson en Alzheimer.
Vanwege zijn chemisch-reducerende vermogen kan het oxidatieve soorten bestrijden en zo cellulaire veroudering tegengaan. Om deze redenen wordt de mogelijkheid bestudeerd om geneesmiddelen te produceren die, wanneer ze aan patiënten worden toegediend, langzaam in het lichaam kunnen worden afgegeven..
Dit zou dienen om pathologieën zoals ischemie, diabetes en neurodegeneratieve ziekten te behandelen. Het werkingsmechanisme en de veiligheid ervan moeten echter nog grondig worden onderzocht..
Artikel index
- 1 Structuur
- 2 Nomenclatuur
- 3 Fysieke eigenschappen
- 3.1 Fysieke toestand
- 3.2 Molecuulgewicht
- 3.3 Smeltpunt
- 3.4 Kookpunt
- 3.5 Dichtheid
- 3.6 Oplosbaarheid
- 4 Chemische eigenschappen
- 4.1 In waterige oplossing
- 4.2 Reactie met zuurstof
- 4.3 Reactie met metalen
- 4.4 Reactie met zwaveldioxide
- 4.5 Ontleding met temperatuur
- 5 Locatie in de natuur
- 6 Synthese in het zoogdierorganisme
- 7 Verkregen in het laboratorium of industrieel
- 8 Industrieel gebruik van H2S om zwavel te produceren
- 9 Nut of belang van endogeen H2S in het lichaam
- 9.1 Cardiovasculair systeem
- 9.2 Maag-darmstelsel
- 9.3 Centraal zenuwstelsel
- 9.4 Gezichtsorgaan
- 9.5 Tegen veroudering
- 9.6 Genezingspotentieel van exogeen geleverde H2S
- 10 Risico's
- 11 Referenties
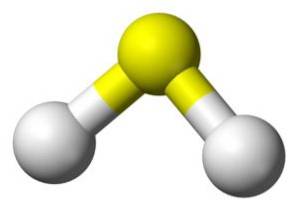
Structuur
Het H-molecuultweeS is analoog aan dat van water, dat wil zeggen, ze hebben een vergelijkbare vorm omdat de waterstofatomen onder een hoek met de zwavel zijn geplaatst.
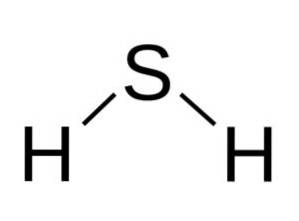
Zwavel in H.tweeS heeft de volgende elektronische configuratie:
1stwee, 2 sectwee 2 Blz6, 3stwee 3p6,
Welnu, het leent één elektron van elke waterstof om zijn valentieschil te voltooien..
Nomenclatuur
- Waterstofsulfide
- Waterstofsulfide
- Zwavelhydride.
Fysieke eigenschappen
Fysieke toestand
Kleurloos gas met een zeer onaangename geur.
Molecuulgewicht
34,08 g / mol.
Smeltpunt
-85,60 ºC.
Kookpunt
-60,75 ºC.
Dichtheid
1.1906 g / l.
Oplosbaarheid
Matig oplosbaar in water: 2,77 volumes in 1 water van 20ºC. Kan door koken volledig uit de waterige oplossing worden verwijderd.
Chemische eigenschappen
In waterige oplossing
Wanneer waterstofsulfide in waterige oplossing is, wordt dit waterstofsulfide genoemd. Het is een zwak zuur. Het heeft twee ioniseerbare protonen:
H.tweeS + HtweeO ⇔ H3OF+ + HS-, Ka1 = 8,9 x 10-8
HS- + H.tweeO ⇔ H3OF+ + Stwee-, Ka2 ∼ 10-14
Het eerste proton ioniseert enigszins, zoals kan worden afgeleid uit zijn eerste ionisatieconstante. Het tweede proton ioniseert heel weinig, maar oplossingen van HtweeS bevatten een deel van het sulfide-anion S.twee-.
Als de oplossing van HtweeS wordt blootgesteld aan lucht, Otwee oxideert tot het sulfide-anion en slaat zwavel neer:
2 S.twee- + 4 uur+ + OFtwee → 2 H.tweeO + 2 S0↓ (1)
In aanwezigheid van chloor Cltwee, broom Brtwee en jodium Itwee het overeenkomstige waterstofhalogenide en zwavel worden gevormd:
H.tweeS + Brtwee → 2 HBr + S0↓ (2)
Waterige oplossingen van HtweeS zijn corrosief, veroorzaken spanningsscheuren door sulfide in staalsoorten met een hoge hardheid. Corrosieproducten zijn ijzersulfide en waterstof.
Reactie met zuurstof
De HtweeS reageert met zuurstof in de lucht en de volgende reacties kunnen optreden:
2 uurtweeS + 3 Otwee → 2 H.tweeO + 2 ZOtwee (3)
2 uurtweeS + Otwee → 2 H.tweeO + 2 S0↓ (4)
Reactie met metalen
Het reageert met verschillende metalen die waterstof verdringen en vormt het metaalsulfide:
H.tweeS + Pb → PbS + Htwee↑ (5)
Reactie met zwaveldioxide
In vulkanische gassen, H.tweeS en SOtwee, die met elkaar reageren en vaste zwavel vormen:
H.tweeS + SOtwee → 2 H.tweeO + 3 S0↓ (6)
Ontleding met temperatuur
Waterstofsulfide is niet erg stabiel, het ontleedt gemakkelijk bij verhitting:
H.tweeS → Htwee↑ + S0↓ (7)
Locatie in de natuur
Dit gas komt van nature voor in zwavelhoudende of zwavelhoudende warmwaterbronnen, in vulkanische gassen, in ruwe olie en in aardgas..

Wanneer olie (of gas) significante sporen van H bevattweeVan S wordt gezegd dat het "zuur" is, in tegenstelling tot "zoet", dat is wanneer het het niet bevat.
Kleine hoeveelheden H.tweeS in olie of gas zijn economisch nadelig omdat er een wasinstallatie moet worden geïnstalleerd om deze te verwijderen, zowel om corrosie te voorkomen als om het afgas veilig te maken voor huishoudelijk gebruik als brandstof.
Het wordt geproduceerd wanneer organisch materiaal dat zwavel bevat wordt afgebroken onder anaerobe omstandigheden (afwezigheid van lucht), zoals menselijk, dierlijk en plantaardig afval.

Bacteriën die in de mond en in het maagdarmkanaal aanwezig zijn, produceren het uit de afbreekbare materialen in planten of dierlijke eiwitten..
Zijn karakteristieke geur maakt het merkbaar in rotte eieren.
De HtweeS wordt ook geproduceerd in bepaalde industriële activiteiten, zoals olieraffinaderijen, cokesovens, papierfabrieken, leerlooierijen en voedselverwerking.
Synthese in het zoogdierorganisme
De HtweeEndogeen S kan worden geproduceerd in zoogdierweefsels, inclusief mensen, via twee routes, een enzymatische en een niet-enzymatische.
De niet-enzymatische route bestaat uit de reductie van elementaire zwavel S.0 tot HtweeS door oxidatie van glucose:
2 C6H.12OF6 (glucose) + 6 S.0 (zwavel) + 3 HtweeO → 3 C3H.6OF3 + 6 uurtweeS + 3 COtwee (8)
De enzymatische route bestaat uit de productie van H.tweeS van L-cysteïne, een aminozuur dat door het lichaam wordt gesynthetiseerd. Het proces wordt verzekerd door verschillende enzymen, zoals onder andere cystathionine-β-synthase en cystathionine-γ-lyase..

Verkrijgen in het laboratorium of industrieel
Waterstofgas (H.twee) en het element zwavel (S) reageren niet bij normale omgevingstemperaturen, maar daarboven beginnen ze te combineren, waarbij 310 ºC de optimale temperatuur is.
Het proces is echter te traag, dus er worden andere methoden gebruikt om het te verkrijgen, waaronder de volgende.
Metaalsulfiden (zoals ferrosulfide) reageren met zuren (zoals zoutzuur) in verdunde oplossing.
FeS + 2 HCl → FeCltwee + H.tweeS ↑ (9)
Op deze manier wordt het gas HtweeS dat, gezien zijn toxiciteit, veilig moet worden verzameld.
Industrieel gebruik van H.tweeS om zwavel te produceren
Opslag en transport in grote hoeveelheden H.tweeHet scheiden van aardgas door amine-wassing is moeilijk, daarom wordt het Claus-proces gebruikt om het in zwavel om te zetten.

Hierbij treden twee reacties op. In de eerste HtweeS reageert met zuurstof om SO te geventwee, zoals hierboven vermeld (zie reactie 3).
De tweede is een door ijzeroxide gekatalyseerde reactie waarbij SOtwee wordt verminderd en de HtweeS oxideert en beide produceren zwavel S (zie reactie 6).
Op deze manier wordt zwavel verkregen dat gemakkelijk kan worden opgeslagen en vervoerd, en dat ook voor meerdere doeleinden kan worden gebruikt..
Bruikbaarheid of belang van HtweeS endogeen in het lichaam
De HtweeEndogeen S is degene die van nature in het lichaam voorkomt als onderdeel van het normale metabolisme bij mensen, zoogdieren en andere levende wezens.
Ondanks zijn langdurige reputatie als een giftig en giftig gas dat wordt geassocieerd met de afbraak van organisch materiaal, hebben verschillende recente onderzoeken uit de jaren 2000 tot heden vastgesteld dat HtweeEndogeen S is een belangrijke regulator van bepaalde mechanismen en processen in het levende wezen.
De HtweeS heeft een hoge lipofiliciteit of affiniteit met vetten, dus het passeert de celmembranen gemakkelijk en dringt alle soorten cellen binnen.
Cardiovasculair systeem
Bij zoogdieren bevordert of reguleert waterstofsulfide een reeks signalen die het metabolisme, de hartfunctie en de celoverleving reguleren..
Het heeft een krachtig effect op het hart, de bloedvaten en circulerende elementen van het bloed. Moduleert het celmetabolisme en de mitochondriale functie.
Beschermt de nieren tegen schade veroorzaakt door ischemie.
Maagdarmstelsel
Het speelt een belangrijke rol als beschermende factor tegen beschadiging van het maagslijmvlies. Geschat wordt dat het een belangrijke mediator kan zijn van gastro-intestinale motiliteit.
Het is waarschijnlijk betrokken bij de controle van de insulinesecretie.
Centraal zenuwstelsel
Het werkt ook in belangrijke functies van het centrale zenuwstelsel en beschermt neuronen tegen oxidatieve stress.
Geschat wordt dat het kan beschermen tegen neurodegeneratieve ziekten zoals de ziekte van Parkinson, Alzheimer en Hungtinton..
Orgaan van visie
Beschermt fotoreceptorcellen van het netvlies tegen door licht veroorzaakte degeneratie.
Tegen veroudering
De HtweeOmdat het een reducerende soort is, kan het worden geconsumeerd door een verscheidenheid aan oxidatiemiddelen die in het lichaam circuleren. Bestrijdt oxiderende soorten zoals reactieve zuurstofsoorten en reactieve stikstofsoorten in het lichaam.
Beperkt reacties van vrije radicalen door de activering van antioxiderende enzymen die beschermen tegen de gevolgen van veroudering.
Genezingspotentieel van H.tweeS exogeen geleverd
De biologische beschikbaarheid van H.tweeEndogeen S is afhankelijk van bepaalde enzymen die betrokken zijn bij de biosynthese van cysteïne bij zoogdieren.
Sommige studies suggereren dat H-donor medicamenteuze behandelingtweeS kan gunstig zijn voor bepaalde pathologieën.
Het kan bijvoorbeeld nuttig zijn bij diabetespatiënten, aangezien is waargenomen dat de bloedvaten van diabetische dieren verbeteren met geneesmiddelen die HtweeS exogeen.
De HtweeExogeen geleverde S verhoogt de angiogenese of de vorming van bloedvaten, zodat het kan worden gebruikt voor de behandeling van chronische ischemische ziekten.
Er worden medicijnen bedacht die H kunnen vrijmakentweeS langzaam om gunstig te kunnen werken bij verschillende ziekten. De werkzaamheid, veiligheid en werkingsmechanismen moeten echter nog worden onderzocht..
Risico's
De HtweeS is een dodelijk gif als het puur wordt ingeademd of zelfs 1 deel gas verdund in 200 delen lucht. Vogels zijn erg gevoelig voor H.tweeS en sterven zelfs in verdunning van 1 op 1500 delen lucht.

De HtweeS is een krachtige remmer van bepaalde enzymen en oxidatieve fosforyleringsprocessen, wat leidt tot celverstikking. De meeste mensen ruiken het bij concentraties van meer dan 5 ppb (delen per miljard). Concentraties van 20-50 ppm (deeltjes per miljoen) zijn irriterend voor de ogen en de luchtwegen.
Een inademing van 100-250 ppm gedurende enkele minuten kan coördinatiestoornissen, geheugenstoornissen en motorische stoornissen veroorzaken. Wanneer de concentratie rond de 150-200 ppm ligt, treedt olfactorische vermoeidheid of anosmie op, waardoor achteraf de kenmerkende geur van H niet kan worden gedetecteerd.tweeS. Bij inademing van een concentratie van 500 ppm gedurende 30 minuten kan longoedeem en longontsteking optreden..
Concentraties van meer dan 600 ppm kunnen binnen de eerste 30 minuten fataal zijn, omdat het ademhalingssysteem verlamd is. En 800 ppm is de concentratie die voor mensen onmiddellijk dodelijk is..
Daarom moet worden vermeden dat er lekkages van H zijntweeS in laboratoria, gebouwen of op elke plaats of situatie.
Het is belangrijk op te merken dat er veel doden vallen omdat mensen besloten ruimtes binnengaan om collega's of familieleden te redden die zijn ingestort als gevolg van H-vergiftiging.tweeJa, ze ook passeren.
Het is een brandbaar gas.
Referenties
- Panthi, S. et al. (2016). Fysiologisch belang van waterstofsulfide: opkomende krachtige neuroprotector en neuromodulator. Oxidatieve geneeskunde en cellulaire levensduur. Jaargang 2016. Artikel-ID 9049782. Opgehaald van hindawi.com.
- Shefa, U. et al. (2018). Antioxidant- en celsignaleringsfuncties van waterstofsulfide in het centrale zenuwstelsel. Oxidatieve geneeskunde en cellulaire levensduur. Jaargang 2018. Artikel-ID 1873962. Opgehaald van hindawi.com.
- Tabassum, R. et al. (2020). Therapeutisch belang van waterstofsulfide bij leeftijdsgebonden neurodegeneratieve ziekten. Neural Regen Res 2020; 15: 653-662. Opgehaald van nrronline.org.
- Martelli, A. et al. (2010). Waterstofsulfide: nieuwe kans voor het ontdekken van geneesmiddelen. Medicinaal onderzoek beoordelingen. Volume 32, Issue 6. Hersteld van onlinelibrary.wiley.com.
- Wang, M.-J. et al. (2010). Mechanismen van angiogenese: rol van waterstofsulfide. Klinische en experimentele farmacologie en fysiologie (2010) 37, 764-771. Hersteld van onlinelibrary.wiley.com.
- Dalefield, R. (2017). Rook en andere ingeademde giftige stoffen. Waterstofsulfide. In veterinaire toxicologie voor Australië en Nieuw-Zeeland. Opgehaald van sciencedirect.com.
- Selley, R.C. en Sonnenberg, S.A. (2015). De fysische en chemische eigenschappen van aardolie. Waterstofsulfide. In Elements of Petroleum Geology (derde editie). Opgehaald van sciencedirect.com.
- Hocking, M.B. (2005). Zwavel en zwavelzuur. Claus-procesomzetting van waterstofsulfide in zwavel. In Handbook of Chemical Technology and Pollution Control (derde editie). Opgehaald van sciencedirect.com.
- Lefer, D.J. (2008). Potentieel belang van veranderingen in waterstofsulfide (H.tweeS) biologische beschikbaarheid bij diabetes. British Journal of Pharmacology (2008) 155, 617-619. Hersteld van bpspubs.onlinelibrary.wiley.com.
- ONS. Nationale bibliotheek van geneeskunde. (2019). Waterstofsulfide. Hersteld van: pubchem.ncbi.nlm.nih.gov.
- Babor, J.A. en Ibarz, J. (1965). Moderne algemene chemie. 7e editie. Redactioneel Marín, S.A.



Niemand heeft nog op dit artikel gereageerd.