
Jodiumzuur (HIO2) eigenschappen en toepassingen

De jodium zuur Het is een chemische verbinding met de formule HIO2. Dit zuur, evenals zijn zouten (bekend als jodieten), zijn extreem onstabiele verbindingen die zijn waargenomen maar nooit zijn geïsoleerd.
Het is een zwak zuur, wat betekent dat het niet volledig dissocieert. In het anion bevindt jodium zich in oxidatietoestand III en heeft het een structuur die analoog is aan chloorzuur of broomzuur, zoals geïllustreerd in figuur 1.
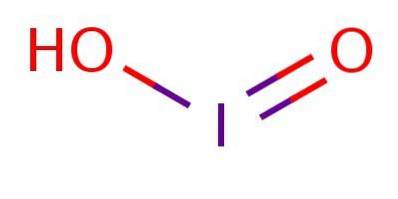
Ondanks dat de verbinding onstabiel is, zijn jodiumzuur en zijn jodietzouten gedetecteerd als tussenproducten bij de omzetting tussen jodiden (I-) en jodaten (IO3-.
De instabiliteit ervan is te wijten aan een dismutatiereactie (of disproportionering) om hypojoodzuur en joodzuur te vormen, dat op de volgende manier analoog is aan chloor- en broomzuren:
2HIO2 -> HIO + HIO3
In Napels in 1823 schreef de wetenschapper Luigi Sementini een brief aan E. Daniell, secretaris van de koninklijke instelling in Londen, waar hij een methode uitlegde om jodiumzuur te verkrijgen..
In de brief zei hij dat gezien het feit dat de vorming van salpeterig zuur was, het combineren van salpeterzuur met wat hij salpeterig gas noemde (mogelijk NtweeO), kon jodiumzuur op dezelfde manier worden gevormd door jodiumzuur te laten reageren met jodiumoxide, een verbinding die hij had ontdekt.
Daarbij verkreeg hij een geelachtig amberkleurige vloeistof die zijn kleur verloor bij contact met de atmosfeer (Sir David Brewster, 1902).
Later ontdekte de wetenschapper M. Wöhler dat het zuur van Sementini een mengsel is van jodiumchloride en moleculair jodium, aangezien het jodiumoxide dat in de reactie werd gebruikt, werd bereid met kaliumchloraat (Brande, 1828).
Artikel index
- 1 Fysische en chemische eigenschappen
- 2 toepassingen
- 2.1 Nucleofiele acylering
- 2.2 Ontmantelingsreacties
- 2.3 Bray-Liebhafsky-reacties
- 3 referenties
Fysische en chemische eigenschappen
Zoals hierboven vermeld, is jodiumzuur een onstabiele verbinding die niet is geïsoleerd, dus de fysische en chemische eigenschappen worden theoretisch verkregen door middel van computationele berekeningen en simulaties (Royal Society of Chemistry, 2015).
Jodiumzuur heeft een molecuulgewicht van 175,91 g / mol, een dichtheid van 4,62 g / ml in vaste toestand, een smeltpunt van 110 graden Celsius (joodzuur, 2013-2016).
Het heeft ook een oplosbaarheid in water van 269 g / 100 ml bij 20 graden Celsius (omdat het een zwak zuur is), heeft een pKa van 0,75 en heeft een magnetische gevoeligheid van −48,0 · 10−6 cm3 / mol (National Center for Biotechnology Informatie, sf).
Omdat jodiumzuur een onstabiele verbinding is die niet is geïsoleerd, is er geen risico om ermee te werken. Door theoretische berekeningen is gevonden dat jodiumzuur niet brandbaar is..
Toepassingen
Nucleofiele acylering
Jodiumzuur wordt gebruikt als een nucleofiel in nucleofiele acyleringsreacties. Het voorbeeld wordt gegeven met de acylering van trifluoracetylen zoals 2,2,2-trifluoracetylbromide, 2,2,2-trifluoracetylchloride, 2,2,2-trifluoracetylfluoride en 2,2,2-trifluoracetyljodide om het iodosyl te vormen. 2,2,2-trifluoracetaat zoals geïllustreerd in respectievelijk figuur 2.1, 2.2, 2.3 en 2.4.

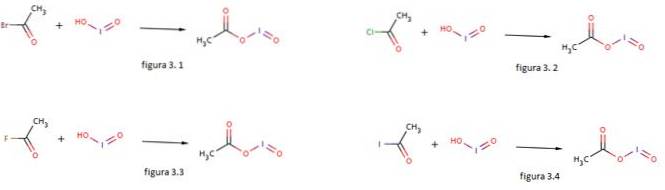
Jodiumzuur wordt ook gebruikt als nucleofiel voor de vorming van jodosylacetaat door het te laten reageren met acetylbromide, acetylchloride, acetylfluoride en acetyljodide, zoals weergegeven in respectievelijk figuren 3.1, 3.2, 3.3 en 3.4 (GNU Free Documentation, sf).
Vernietigingsreacties
Dismutatie- of disproportioneringsreacties zijn een soort oxidatiereductiereactie, waarbij de stof die wordt geoxideerd dezelfde is die wordt gereduceerd.
In het geval van halogenen, aangezien ze oxidatietoestanden van -1, 1, 3, 5 en 7 hebben, kunnen verschillende producten van dismutatiereacties worden verkregen, afhankelijk van de gebruikte omstandigheden..
In het geval van jodiumzuur, het voorbeeld van hoe het reageert om hypojoodzuur en jodiumzuur van de vorm te vormen.
2HIO2 -> HIO + HIO3
Recente studies hebben de dismutatiereactie van jodiumzuur geanalyseerd door de concentraties van protonen (H.+), jodaat (IO3-) en het zure hypojodietkation (H.tweeIO+) om het mechanisme van jodiumzuur-dismutatie beter te begrijpen (Smiljana Marković, 2015).
Er werd een oplossing bereid die de tussensoort I bevat3+. Een mengsel van jodium (I) en jodium (III) soorten werd bereid door jodium (Itwee) en kaliumjodaat (KIO3), in de verhouding 1: 5, in geconcentreerd zwavelzuur (96%). In deze oplossing verloopt een complexe reactie, die kan worden beschreven door de reactie:
iktwee + 3IO3- + 8H+ - 5IO+ + H.tweeOF
Soort I3+ ze zijn alleen stabiel in aanwezigheid van een overmaat toegevoegd jodaat. Jodium voorkomt de vorming van I3+. Het IO-ion+ Verkregen in de vorm van jodiumsulfaat (IO) tweeSW4), ontleedt snel in zure waterige oplossing en vorm I3+, weergegeven als zuur HIOtwee of de ionische soort IO3-. Vervolgens werd een spectroscopische analyse uitgevoerd om de waarde van de concentraties van de ionen van belang te bepalen..
Dit presenteerde een procedure voor de evaluatie van pseudo-evenwichtsconcentraties van waterstof, jodaat en H-ionen.tweeIK VERNAM+, Kinetische en katalytische soorten die belangrijk zijn in het proces van disproportionering van jodiumzuur, HIOtwee.
Bray-Liebhafsky-reacties
Een chemische klok of oscillatiereactie is een complex mengsel van reagerende chemische verbindingen, waarbij de concentratie van een of meer componenten periodiek verandert, of wanneer plotselinge veranderingen in eigenschappen optreden na een voorspelbare inductietijd..
Ze zijn een klasse van reacties die dienen als een voorbeeld van niet-evenwichtsthermodynamica, resulterend in de totstandkoming van een niet-lineaire oscillator. Ze zijn theoretisch belangrijk omdat ze laten zien dat chemische reacties niet gedomineerd hoeven te worden door thermodynamisch evenwichtsgedrag..
De Bray-Liebhafsky-reactie is een chemische klok die voor het eerst werd beschreven door William C. Bray in 1921 en is de eerste oscillatiereactie in een geroerde homogene oplossing..
Jodiumzuur wordt experimenteel gebruikt om dit type reactie te bestuderen wanneer het wordt geoxideerd met waterstofperoxide, waarbij een betere overeenkomst wordt gevonden tussen het theoretische model en experimentele waarnemingen (Ljiljana Kolar-Anić, 1992).
Referenties
- Brande, W. T. (1828). Een chemisch handboek, op basis van professor Brande. Boston: Universiteit van Harvard.
- GNU gratis documentatie. (s.f.). joodig zuur. Opgehaald van chemsink.com: chemsink.com
- joodig zuur. (2013-2016). Opgehaald van molbase.com: molbase.com
- Ljiljana Kolar-Anić, G.S. (1992). Mechanisme van de Bray-Liebhafsky-reactie: effect van de oxidatie van joodzuur door waterstofperoxide. Chem.Soc., Faraday Trans 1992,88, 2343-2349. http://pubs.rsc.org/en/content/articlelanding/1992/ft/ft9928802343#!divAbstract
- Nationaal centrum voor informatie over biotechnologie. (n.d.). PubChem samengestelde database; CID = 166623. Opgehaald van pubchem.com:pubchem.ncbi.nlm.nih.gov.
- Royal Society of Chemistry. (2015). Joodzuur ChemSpider ID145806. Opgehaald van ChemSpider: chemspider.com
- Sir David Brewster, R. T. (1902). The London en Edinburgh Philosophical Magazine en Journal of Science. londen: universiteit van londen.
- Smiljana Marković, R. K. (2015). Disproportioneringsreactie van joodzuur, HOIO. Bepaling van de concentraties van de relevante ionsoorten H +, H2OI + en IO3 -.


Niemand heeft nog op dit artikel gereageerd.