
Zure kenmerken en voorbeelden

De zuren het zijn verbindingen met een sterke neiging om protonen af te staan of een paar elektronen te accepteren. Er zijn veel definities (Bronsted, Arrhenius, Lewis) die de eigenschappen van zuren karakteriseren, en elk ervan wordt aangevuld om een globaal beeld van dit soort verbindingen op te bouwen..
Vanuit het bovenstaande perspectief kunnen alle bekende stoffen zuur zijn, maar alleen de stoffen die ver boven de andere uitkomen, worden als zodanig beschouwd. Met andere woorden: als een stof een extreem zwakke protonendonor is, vergeleken met bijvoorbeeld water, kan gezegd worden dat het geen zuur is.

Wat zijn nu precies de zuren en hun natuurlijke bronnen? Een typisch voorbeeld hiervan is te vinden in veel fruit: zoals citrus. Limonades hebben hun karakteristieke smaak dankzij citroenzuur en andere componenten.
De tong kan de aanwezigheid van zuren detecteren, net als bij andere smaken. Afhankelijk van de zuurgraad van deze verbindingen, wordt de smaak ondraaglijker. Op deze manier functioneert de tong als een organoleptische meter voor de concentratie van zuren, met name de concentratie van hydroniumionen (H3OF+.
Aan de andere kant worden zuren niet alleen in voedsel aangetroffen, maar ook in levende organismen. Evenzo bevatten bodems stoffen die ze als zuur kunnen karakteriseren; dat is het geval bij aluminium en andere metaalkationen.
Artikel index
- 1 Kenmerken van zuren
- 1.1 - Fysieke eigenschappen
- 1.2 - Mogelijkheid om protonen te genereren
- 1.3 - Ze hebben waterstofatomen met een lage elektronendichtheid
- 1.4 - Sterkte of zuurgraad constant
- 1.5 - Het heeft zeer stabiele geconjugeerde basen
- 1.6 - Ze kunnen positieve ladingen hebben
- 1.7 - Uw oplossingen hebben pH-waarden lager dan 7
- 1.8 - Mogelijkheid om basen te neutraliseren
- 2 Sterke zuren en zwakke zuren
- 3 Voorbeelden van zuren
- 3.1 Waterstofhalogeniden
- 3.2 Oxozuren
- 3.3 Super zuren
- 3.4 Organische zuren
- 4 referenties
Kenmerken van zuren
Welke kenmerken moet een verbinding volgens de bestaande definities hebben om als zuur te worden beschouwd??
Moet H-ionen kunnen genereren+ en OH- wanneer het in water oplost (Arrhenius), moet het heel gemakkelijk protonen aan andere soorten afstaan (Bronsted) of ten slotte moet het in staat zijn om een paar elektronen te accepteren, waarbij het zichzelf negatief oplaadt (Lewis).
Deze kenmerken hangen echter nauw samen met de chemische structuur. Daarom is het, door het te leren analyseren, mogelijk om de zuurgraad of een aantal verbindingen af te leiden, welke van de twee het meest zuur is..
- Fysieke eigenschappen
Zuren hebben een smaak die de overtolligheid waard is, zuur en hun geur brandt vaak de neusgaten. Het zijn vloeistoffen met een plakkerige of olieachtige textuur en kunnen de kleur van lakmoespapier en methyloranje veranderen in rood (Properties of Acids and Bases, S.F.).
- Mogelijkheid om protonen te genereren
In 1923 introduceerden de Deense chemicus Johannes Nicolaus Brønsted en de Engelse chemicus Thomas Martin Lowry de theorie van Brønsted en Lowry, waarin ze stelden dat elke verbinding die een proton naar een andere verbinding kan overbrengen een zuur is (Encyclopædia Britannica, 1998). Bijvoorbeeld in het geval van zoutzuur:
HCl → H+ + Cl-
De theorie van Brønsted en Lowry kon het zuurgedrag van bepaalde stoffen niet verklaren. In 1923 introduceerde de Amerikaanse chemicus Gilbert N. Lewis zijn theorie, waarin een zuur wordt beschouwd als elke verbinding die, in een chemische reactie, in staat is om een paar elektronen te verbinden die niet gedeeld zijn in een ander molecuul (Encyclopædia Britannica, 1998).
Op deze manier kunnen ionen zoals Cutwee+, gelooftwee+ en het geloof3+ Ze hebben het vermogen om te binden met paren vrije elektronen, bijvoorbeeld uit water om protonen te produceren op de manier:
Cutwee+ + 2HtweeO → Cu (OH)twee + 2H+
- Ze hebben waterstofatomen met een lage elektronendichtheid
Voor het methaanmolecuul, CH4, geen van zijn waterstofatomen is elektronisch deficiënt. Dit komt omdat het elektronegativiteitsverschil tussen koolstof en waterstof erg klein is. Maar als een van de H-atomen zou worden vervangen door een van fluor, dan zou er een merkbare verandering in het dipoolmoment zijn: HtweeFC-H..
H. het ervaart een verplaatsing van zijn elektronenwolk naar het aangrenzende atoom gebonden aan de F, wat hetzelfde is, δ + neemt toe. Nogmaals, als een andere H wordt vervangen door een andere F, dan ziet het molecuul eruit als: HFtweeC-H..
Nu is δ + zelfs nog hoger, omdat het twee sterk elektronegatieve F-atomen zijn, die de elektronendichtheid aftrekken van C, en de laatste dus van C H.. Als het substitutieproces werd voortgezet, zou het uiteindelijk worden verkregen: F3C-H..
In dit laatste molecuul H. vertoont, als gevolg van de drie naburige F-atomen, een duidelijk elektronisch defect. Deze δ + blijft niet onopgemerkt door een soort die rijk genoeg is aan elektronen om dit te strippen H. en dus F3CH wordt negatief geladen:
F.3C-H. + : N- (negatieve soorten) => F.3C:- + H.N
De bovenstaande chemische vergelijking kan ook als volgt worden beschouwd: F3CH schenkt een proton (H.+, de H. eenmaal losgemaakt van het molecuul) a: N; o, F3CH haalt er een paar elektronen uit H. als een ander paar werd geschonken aan de laatste van: N-.
- Zuursterkte of constant
Hoeveel F3C:- is het aanwezig in de oplossing? Of, hoeveel moleculen van F3CH kan waterstofzuur doneren aan N? Om deze vragen te beantwoorden, is het noodzakelijk om de concentratie van F te bepalen3C:- of van H.N en stel met behulp van een wiskundige vergelijking een numerieke waarde vast die de zuurconstante Ka wordt genoemd.
Hoe meer moleculen van F3C:- of HN wordt geproduceerd, hoe meer zuur F zal zijn3CH en groter zijn Ka. Op deze manier helpt Ka om kwantitatief te verduidelijken welke verbindingen zuurder zijn dan andere; en evenzo verwerpt het als zuren die waarvan de Ka van een buitengewoon kleine orde is.
Sommige Ka kunnen waarden hebben rond de 10-1 en 10-5, en anderen, waarden miljoensten kleiner, zoals 10-vijftien en 10-35. Men kan dan zeggen dat laatstgenoemde, met genoemde zuurgraadconstanten, extreem zwakke zuren zijn en als zodanig kunnen worden weggegooid..
Dus welke van de volgende moleculen heeft de hoogste Ka: CH4, CH3F, CHtweeF.twee of CHF3? Het antwoord ligt in het ontbreken van elektronendichtheid, δ +, in hun waterstofatomen..
Afmetingen
Maar wat zijn de criteria voor het standaardiseren van Ka-metingen? De waarde ervan kan enorm variëren, afhankelijk van welke soort de H zal ontvangen+. Als: N een sterke basis is, zal Ka bijvoorbeeld groot zijn; maar als het daarentegen een erg zwakke basis is, zal Ka klein zijn.
Ka-metingen worden uitgevoerd met de meest voorkomende en zwakste van alle basen (en zuren): water. Afhankelijk van de mate van donatie van H+ naar H-moleculentweeOf, bij 25 ° C en bij een druk van één atmosfeer, worden de standaardomstandigheden vastgesteld om de zuurgraadconstanten voor alle verbindingen te bepalen.
Hieruit ontstaat een repertoire van tabellen met zuurconstanten voor veel verbindingen, zowel anorganisch als organisch..
- Het heeft zeer stabiele geconjugeerde basen
Zuren hebben sterk elektronegatieve atomen of eenheden (aromatische ringen) in hun chemische structuren die elektronendichtheden aantrekken van omringende waterstofatomen, waardoor ze gedeeltelijk positief en reactief worden met een base..
Zodra de protonen doneren, verandert het zuur in een geconjugeerde base; dat wil zeggen, een negatieve soort die H kan accepteren+ of doneer een paar elektronen. In het voorbeeld van het CF-molecuul3H zijn geconjugeerde base is CF3-
CF3- + HN <=> CHF3 + : N-
Ja CF3- is een zeer stabiele geconjugeerde base, het evenwicht zal meer naar links dan naar rechts worden verschoven. Ook, hoe stabieler het is, hoe reactiever en zuurder het zuur zal zijn..
Hoe weet je hoe stabiel ze zijn? Het hangt allemaal af van hoe ze omgaan met de nieuwe negatieve lading. Als ze het kunnen delokaliseren of de toenemende elektronendichtheid efficiënt kunnen diffunderen, zal het niet beschikbaar zijn voor gebruik bij binding met de basis H..
- Ze kunnen positieve ladingen hebben
Niet alle zuren hebben elektron-deficiënte waterstofatomen, maar ze kunnen ook andere atomen hebben die elektronen kunnen opnemen, met of zonder een positieve lading..
Hoe is dit? Bijvoorbeeld in boortrifluoride, BF3, het B-atoom mist een octet van valentie, dus het kan een binding aangaan met elk atoom dat het een paar elektronen geeft. Als een anion F- rond in zijn nabijheid vindt de volgende chemische reactie plaats:
BF3 + F.- => BF4-
Aan de andere kant, vrije metaalkationen, zoals Al3+, Zntwee+, Na+, enz., worden als zuur beschouwd, omdat ze vanuit hun omgeving datieve (coördinatie) bindingen van elektronenrijke soorten kunnen accepteren. Ze reageren ook met OH-ionen- neerslaan als metaalhydroxiden:
Zntwee+(aq) + 2OH-(ac) => Zn (OH)twee(s)
Deze staan allemaal bekend als Lewis-zuren, terwijl degenen die protonen afstaan Bronsted-zuren zijn..
- Hun oplossingen hebben pH-waarden van minder dan 7
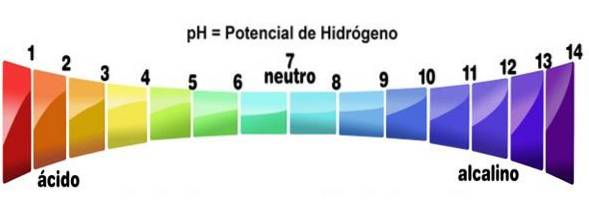
Meer specifiek, wanneer een zuur oplost in een oplosmiddel (dat neutraliseert het niet merkbaar), genereert het oplossingen met een pH lager dan 3, hoewel lager dan 7 ze als zeer zwakke zuren worden beschouwd..
Dit kan worden geverifieerd door een zuur-base-indicator te gebruiken, zoals fenolftaleïne, universele indicator of paars koolsap. Die verbindingen die de kleuren veranderen in die welke zijn aangegeven voor een lage pH, worden behandeld als zuren. Dit is een van de eenvoudigste tests om de aanwezigheid ervan te bepalen..
Hetzelfde kan bijvoorbeeld worden gedaan voor verschillende bodemmonsters uit verschillende delen van de wereld, waardoor hun pH-waarden worden bepaald om, samen met andere variabelen, ze te karakteriseren..
En tot slot hebben alle zuren een zure smaak, zolang ze niet zo geconcentreerd zijn dat ze de weefsels van de tong onomkeerbaar verbranden..
- Mogelijkheid om basen te neutraliseren
Arrhenius stelt in zijn theorie dat zuren, doordat ze protonen kunnen genereren, op de volgende manier reageren met de hydroxyl van de basen om zout en water te vormen:
HCl + NaOH → NaCl + HtweeOF.
Deze reactie wordt neutralisatie genoemd en vormt de basis van de analytische techniek die titratie wordt genoemd (Bruce Mahan, 1990).
Sterke zuren en zwakke zuren
Zuren worden ingedeeld in sterke zuren en zwakke zuren. De sterkte van een zuur hangt samen met de evenwichtsconstante, daarom worden deze constanten in het geval van zuren zuurconstanten Ka genoemd..
Sterke zuren hebben dus een grote zuurconstante, zodat ze de neiging hebben om volledig te dissociëren. Voorbeelden van deze zuren zijn zwavelzuur, zoutzuur en salpeterzuur, waarvan de zuurconstanten zo groot zijn dat ze niet in water kunnen worden gemeten..
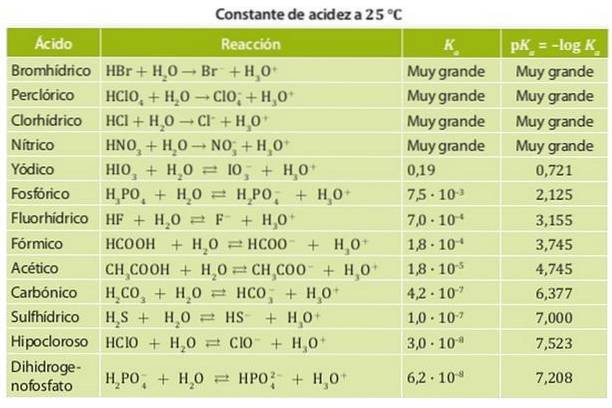
Aan de andere kant is een zwak zuur een zuur waarvan de dissociatieconstante laag is, dus het bevindt zich in chemisch evenwicht. Voorbeelden van deze zuren zijn azijnzuur en melkzuur en salpeterig zuur waarvan de zuurgraadconstanten in de orde van 10 zijn-4. Figuur 1 toont de verschillende zuurgraadconstanten voor verschillende zuren.
Voorbeelden van zuren
Waterstofhalogeniden
Alle waterstofhalogeniden zijn zure verbindingen, vooral wanneer ze zijn opgelost in water:
-HF (fluorwaterstofzuur).
-HCl (zoutzuur).
-HBr (broomwaterstofzuur).
-HI (jodiumzuur).
Oxoacids
Oxozuren zijn de geprotoneerde vormen van oxoanionen:
HNO3 (salpeterzuur).
H.tweeSW4 (zwavelzuur).
H.3PO4 (fosforzuur).
HClO4 (perchloorzuur).
Super zuren
Superzuren zijn het mengsel van een sterk Bronsted-zuur en een sterk Lewis-zuur. Eenmaal gemengd vormen ze complexe structuren waarbij, volgens bepaalde studies, de H+ "Spring" erin.
Hun corrosieve kracht is zodanig dat ze miljarden keren sterker zijn dan H.tweeSW4 geconcentreerd. Ze worden gebruikt om grote moleculen die aanwezig zijn in ruwe olie te kraken tot kleinere, vertakte moleculen en met een grote economische meerwaarde..
-BF3/ HF
-SbF5/ HF
-SbF5/ HSO3F.
-CF3SW3H.
Organische zuren
Organische zuren worden gekenmerkt door een of meer carbonzuurgroepen (COOH), waaronder:
-Citroenzuur (aanwezig in veel fruit)
-Appelzuur (van groene appels)
-Azijnzuur (van commerciële azijn)
-Boterzuur (van ranzig boter)
-Wijnsteenzuur (uit wijnen)
-En de vetzuurfamilie.
Referenties
- Torrens H. Harde en zachte zuren en basen. [Pdf]. Genomen uit: depa.fquim.unam.mx
- Helmenstine, Anne Marie, Ph.D. (3 mei 2018). Namen van 10 gewone zuren. Hersteld van: thoughtco.com
- Chempages Netorials. Zuren en basen: moleculaire structuur en gedrag. Genomen uit: chem.wisc.edu
- Deziel, Chris. (27 april 2018). Algemene kenmerken van zuren en basen. Wetenschappelijk. Hersteld van: sciencing.com
- Pittsburgh Supercomputing Center (PSC). (25 oktober 2000). Hersteld van: psc.edu.



Niemand heeft nog op dit artikel gereageerd.