
Cytotrofoblast kenmerken, ontwikkeling en functie
De cytotrofoblast of Langhans-cellen, is het deel van het basismembraan van de trofoblast dat bestaat uit cellen met een kern. Dit deel komt overeen met de populatie stamcellen, waarvan de andere trofoblasten zijn afgeleid..
Deze laag cellen is vanuit mitotisch oogpunt zeer actief en produceert cellen die binden aan de syncytiotrofoblast. De cytotrofoblast is afkomstig uit de implantatieperiode van de blastocyst in de embryonale ontwikkeling van zoogdieren. Tijdens deze ontwikkelingsfase prolifereren trofoblastische cellen en maken plaats voor invasie in het endometriumepitheel..
Artikel index
- 1 Kenmerken
- 1.1 Extravillous cytotrofoblast
- 2 Ontwikkeling en functie
- 2.1 Vorming van de placenta
- 2.2 Moeder-foetale interface
- 2.3 De placentabarrière scheidt het bloed van de moeder en de foetus
- 3 referenties
Kenmerken
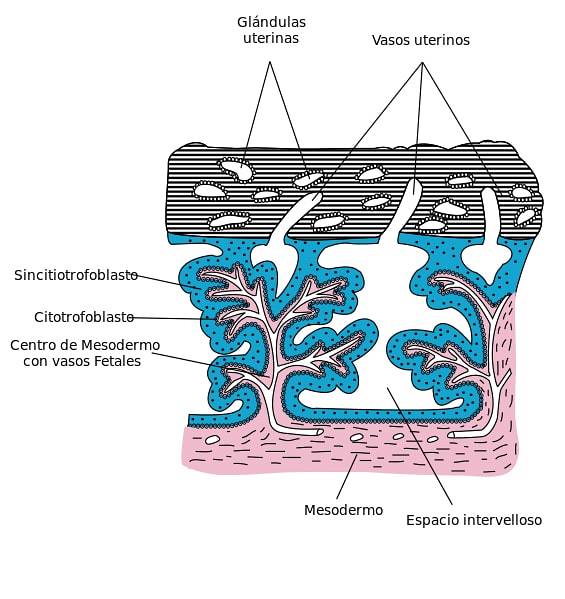
Een laag van eenkernige cellen vormen de cytotrofoblast, aan de binnenkant van de trofoblast. Deze cellen bevinden zich in de chorionvlokken en worden gedekt door de syncytiotrofoblast. De cytotrofoblast wordt gekenmerkt door een hoge celdifferentiatie en proliferatiecapaciteit en lage functionele activiteit.
Tijdens de embryo-implantatiefase of -venster ontstaan de cytotrofoblastcellen, worden kubusvormig en bleek met een goed nucleair beeld en goed van elkaar gedifferentieerd..
De proliferatie van cytotrofoblastische cellen vindt plaats door continue celvermenigvuldiging. Geschat wordt dat minstens de helft van de cellen in deze laag een celcyclus doormaakt. Naast proliferatie is er een hoge celdifferentiatie die de syncytiotrofoblastlaag en de extravillous cytotrofoblast genereert.
Extravillous cytotrofoblast
De extravillous cytotrofoblast bevindt zich extern op de chorionische villi. Deze cellaag prolifereert snel en dringt het baarmoederstroma en de spiraalvormige arteriën van het endometrium binnen, waardoor de weerstand van de vaatwanden wordt verminderd. Er worden twee soorten extravillous cytotrofoblasten onderscheiden: interstitiële en endovasculaire.
In de interstitiële ruimte dringen cellen het myometrium binnen om te fuseren en grote placentacellen te worden. Deze cellen dringen de vaatwanden niet binnen.
Het endovasculaire, aan de andere kant, binnendringt de vaatwanden en vernietigt de gladde cellen van de middelste laag van het bloedvat, in plaats van fibrinoïde materiaal. Door de diffusie van moleculen die een endotheliaal fenotype simuleren, kan het endotheel van de bloedvaten van de moeder worden vervangen door een nieuw intern oppervlak.
Cytotrofoblastactiviteit wordt gereguleerd door genetische, transcriptie, groei, hormonale en chemische factoren (zoals moleculaire zuurstofconcentratie).
Ontwikkeling en functie
Bij zoogdieren vindt na bevruchting van de eicel door een sperma een reeks celdelingen plaats totdat de blastocyst wordt gevormd, een holle celbol waar de laag perifere cellen aanleiding geeft tot de trofoblast, terwijl het cluster van interne cellen ontstaat de weefsels van het embryo, die embryoblast worden genoemd.
De blastocyst hecht zich tijdens de implantatie aan het baarmoederslijmvlies. Trofoblastische cellen beginnen te diffunderen wanneer ze in contact komen met het endometrium, waardoor een onderscheid wordt gemaakt tussen de cytotrofoblast en de syncytiotrofoblast..
Bij de mens vindt implantatie ongeveer op de zesde dag na de ovulatie en bevruchting van de eicel plaats..
Bij sommige zoogdieren wordt deze fase dagen, weken of zelfs maanden uitgesteld om de komst van een nieuw kalf op een niet gunstig moment te voorkomen, zoals in perioden waarin de middelen afnemen of terwijl de moeder een ander kalf borstvoeding geeft. ..
Bij dieren zoals beren, dassen, zeehonden en kamelen is er een vertraging in het implantatievenster dat bekend staat als embryonale diapauze..
De blastocyst blijft in deze toestand, zonder proliferatie van cytotrofoblastische cellen, vanwege hormonale werking. Dit mechanisme wordt geactiveerd als reactie op omgevingsfactoren of langdurige lactatieperioden bij de moeder..
Vorming van de placenta
De placenta is verantwoordelijk voor het in stand houden van de zich ontwikkelende foetus en is afgeleid van het chorion (foetale gedeelte) en de decidua basalis (moedergedeelte). Daarin vinden gas- en metabolietuitwisselingen plaats tussen de maternale en foetale circulaties. Dit orgaan ontwikkelt zich wanneer differentieerbare villi ontstaan.
Naarmate cytotrofoblastcellen zich uitbreiden en met de ontwikkeling van het chorionmesenterium en de bloedvaten, worden primaire, secundaire en tertiaire chorionvlokken gevormd.
De cytotrofoblast prolifereert snel en geeft zijn cellen over in bloedplassen in de syncytiotrofoblast, waardoor de primaire chorionvlokken worden gevormd..
Vervolgens worden deze villi binnengedrongen door het embryonale mesenchym van het chorion dat binnen blijft en wordt omgeven door de cytotrofoblast, waardoor de secundaire villi worden gevormd die de chorionzak bedekken..
Tertiaire villi worden gevormd met het verschijnen van bloedvaten in het mesenchym van de secundaire villi.
Terwijl de tertiaire villi worden gevormd, diffunderen draden of clusters van cellen van de cytotrofoblast naar buiten door de syncytiotrofoblast..
Op deze manier gaan verschillende celagglomeraten naar buiten en voegen zich bij elkaar, waarbij ze de syncytiotrofoblast bedekken met een cytotrofoblastische omhulling. Deze bedekking wordt onderbroken waar de bloedvaten van de moeder naar de tussenliggende ruimtes gaan..
Moeder-foetale interface
De eerste fase van de maternale-foetale interface bestaat uit de invasie van de extravillous cytotrofoblast (gelegen buiten de placentale villi) in de uteriene spiraalslagaders, waardoor deze slagaders de kenmerken hebben van een hoog kaliber te zijn en een lage stromingsweerstand hebben. Op deze manier wordt een adequate doorbloeding voor de groei van de foetus gehandhaafd..
In de tweede fase combineren de cytotrofoblastcellen zich, waarbij ze hun celmembranen ongedaan maken, om de meerkernige laag van de syncytiotrofoblast te doen ontstaan. De laatste omhult de gedifferentieerde villi van de placenta.
De goede ontwikkeling van deze twee stadia van de interface, zorgt voor een correcte placentatie en daarmee voor een succesvolle ontwikkeling van de foetus en een veilig verloop van de zwangerschapstoestand..
De placentabarrière scheidt het bloed van de moeder en de foetus
Een placentabarrière, hoofdzakelijk gevormd door de lagen foetaal weefsel, is verantwoordelijk voor het scheiden van het bloed van de foetus van het moederbloed. Bij mensen wordt deze barrière vanaf de vierde ontwikkelingsmaand erg dun, waardoor de overdracht van producten erdoorheen wordt vergemakkelijkt..
De degeneratie van de schaal of cytotrofoblastische omhulling is de oorzaak van het dunner worden van de placentabarrière, in wiens gedegenereerde toestand het bestaat uit syncytiotrofoblast, discontinue cytotrofoblastische omhulling, trofoblast basale lamina, villus mesenchym, endotheliale basale lamina en placentale capillaire endotheel villiaire villiaire.
De placentabarrière scheidt niet alleen het bloed van de moeder en het foetale bloed, maar is ook verantwoordelijk voor de uitwisseling van zuurstof en kooldioxide en metabolieten tussen de circulatie van de moeder en de foetus..
Referenties
- Hernández-Valencial, M., Valencia-Ortega, J., Ríos-Castillo, B., Cruz-Cruz, P. D. R., & Vélez-Sánchez, D. (2014). Elementen van implantatie en placentatie: klinische en meleculaire aspecten. Mexican Journal of Reproductive Medicine, 6 (2), 102-116.
- Hill, R. W., Wyse, G. A., Anderson, M., & Anderson, M. (2004). Dierlijke fysiologie (Deel 2). Sunderland, MA: Sinauer Associates.
- Kardong, K. V. (1995). Gewervelde dieren: vergelijkende anatomie, functie, evolutie. Ed McGraw Hill.
- Rodríguez, M., Couve, C., Egaña, G., & Chamy, V. (2011). Placenta-apoptose: moleculaire mechanismen bij het ontstaan van pre-eclampsie. Chileens Tijdschrift voor Verloskunde en Gynaecologie, 76 (6), 431-438.
- Ross, M. H., en Pawlina, W. (2007). Histologie. Panamerican Medical Ed..
- Welsch, U., & Sobotta, J. (2008). Histologie. Panamerican Medical Ed..



Niemand heeft nog op dit artikel gereageerd.