
Formule, effecten, toepassingen en risico's van chloorgas
De chloor gas (dichloor, diatomisch chloor, moleculair chloor of gewoon chloor) is een groenachtig geel gas, met een penetrante en verstikkende geur, niet brandbaar bij kamertemperatuur en atmosferische druk.
Het is het element met de hoogste elektronenaffiniteit en de derde hoogste elektronegativiteit, achter alleen zuurstof en fluor. Het is extreem reactief en een sterk oxidatiemiddel.
Het hoge oxidatiepotentieel van elementair chloor leidde tot de ontwikkeling van commerciële bleekmiddelen en desinfectiemiddelen, evenals een reagens voor veel processen in de chemische industrie..
In de vorm van chloride-ionen is chloor nodig voor alle bekende soorten leven. Maar elementair chloor in hoge concentraties is buitengewoon gevaarlijk en giftig voor alle levende organismen, en daarom werd het in de Eerste Wereldoorlog gebruikt als het eerste gasvormige chemische oorlogsmiddel..

Het is giftig bij inademing. Langdurige inademing van lage concentraties of kortdurende inademing van hoge concentraties chloorgas hebben schadelijke gevolgen voor de gezondheid..
Dampen zijn veel zwaarder dan lucht en hebben de neiging zich te vestigen in lage ruimtes. Het brandt niet, maar ondersteunt de verbranding. Het is slecht oplosbaar in water. Contact met niet-ingesloten vloeistoffen kan bevriezing door verdampingskoeling veroorzaken.
Wordt gebruikt om water te zuiveren, houtpulp te bleken en andere chemicaliën te maken.
Artikel index
- 1 Formule
- 2 2D-structuur
- 3 kenmerken
- 3.1 Fysische en chemische eigenschappen
- 3.2 Reactiviteitswaarschuwingen
- 3.3 Ontvlambaarheid
- 3.4 Reactiviteit
- 3.5 Toxiciteit
- 4 toepassingen
- 5 Klinische effecten
- 6 Veiligheid en risico's
- 6.1 GHS-gevarenklassen
- 6.2 Codes voor veiligheidsaanbevelingen
- 7 referenties
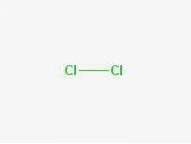
Formule
Formule: Cl-Cl
CAS-nummer: 7782-50-5
2D-structuur

Kenmerken
Fysische en chemische eigenschappen

Chloorgas behoort tot de reactieve groep van sterke oxidatiemiddelen. Deze verbindingen reageren vaak heftig met andere verbindingen..
Chloorgas behoort ook tot de reactieve groep van sterke halogeneringsmiddelen, die een of meer halogeenatomen overdragen aan de verbinding waarmee ze reageren..
Halogeneringsmiddelen zijn over het algemeen zuur en reageren daarom in sommige gevallen heftig met basen.
Veel van deze verbindingen zijn reactief met water en reactief met lucht. Halogenen zijn sterk elektronegatieve en sterk oxiderende stoffen.
Reactiviteitswaarschuwingen
Chloorgas is een sterk oxidatiemiddel. Reageert met water. Water lost chloorgas op en vormt een mengsel van zoutzuur en hypochloorzuren.
Ontvlambaarheid
Het kan andere brandbare materialen doen ontbranden (hout, papier, olie enz.). Het mengen met brandstoffen kan een explosie veroorzaken. Container kan ontploffen bij contact met vuur. Er bestaat gevaar voor explosie (en vergiftiging) door de ophoping van dampen binnenshuis, in riolen of buitenshuis..
Waterstof- en chloormengsels (5-95%) kunnen exploderen door de werking van bijna elke vorm van energie (hitte, zonlicht, vonken, enz.).
Het geeft bij verhitting zeer giftige dampen af. In combinatie met water of stoom produceert het giftige en bijtende dampen van zoutzuur.
Reactiviteit
Chloor reageert explosief met (of ondersteunt de verbranding van) veel gangbare materialen.
- Chloor ontsteekt staal bij 100 ° C in aanwezigheid van roet, oxide, koolstof of andere katalysatoren.
- Zet de droge staalwol aan op 50 ° C.
- Ontsteek sulfiden bij kamertemperatuur.
- Ontsteekt (in zijn vloeibare vorm) natuurlijk en synthetisch rubber.
- Ontsteekt trialkylboranen en wolfraamdioxide.
- Ontbrandt in contact met hydrazine, hydroxylamine en calciumnitride.
- Ontbrandt of explodeert met arsine, fosfine, silaan, diboraan, stibine, rode fosfor, witte fosfor, boor, actieve koolstof, silicium, arseen.
- Veroorzaakt ontbranding en een zachte explosie bij het borrelen door koude methanol.
- Ontploft of ontbrandt bij overmatige menging met ammoniak en verhitting.
- Vormt explosief stikstoftrichloride bij contact met biureetreagens, verontreinigd met cyanuurzuur.
- Vormt gemakkelijk explosieve derivaten van N-chloor met aziridine.
Chloor (in vloeibare of gasvormige vorm) reageert met:
- Alcoholen (explosie)
- Gesmolten aluminium (explosie)
- Silanes (explosie)
- Broom pentafluoride
- Koolstofdisulfide (door ijzer gekatalyseerde explosie)
- Chloor-2-propyn (overtollig chloor veroorzaakt een explosie)
- Dibutylftalaat (explosie bij 118 ° C)
- Diethylether (verlicht)
- Diethylzink (verlicht)
- Glycerol (explosie bij 70-80 ° C)
- Methaan op geel kwikoxide (explosie)
- Acetyleen (explosie veroorzaakt door zonlicht of verwarming)
- Ethyleen op kwik, kwik (I) oxide of zilver (I) oxide (explosie veroorzaakt door hitte of licht)
- Benzine (exotherme reactie en vervolgens ontploffing)
- Nafta-natriumhydroxide-mengsel (gewelddadige explosie)
- Zinkchloride (exotherme reactie)
- Wax (ontploffing)
- Waterstof (explosie geïnitieerd door licht)
- IJzercarbide
- Uranium en zirkonium
- Natrium-, kalium- en koperhydriden
- Blik
- Aluminium poeder
- Vanadium poeder
- Aluminiumfolie
- Klatergoud
- Koperfolie
- Calcium poeder
- Ijzerdraad
- Mangaanpoeder
- Kalium
- Antimoon poeder
- Bismut
- Germanium
- Magnesium
- Natrium
- Zink
Toxiciteit
Chloorgas is giftig en kan bij inademing dodelijk zijn. Contact kan brandwonden aan de huid en ogen veroorzaken, evenals bronchitis of chronische longaandoeningen..

Toepassingen
Momenteel worden ongeveer 15.000 chloorverbindingen commercieel gebruikt. Natriumchloride is verreweg de meest voorkomende chloorverbinding en is de belangrijkste bron van chloor en zoutzuur voor de enorme chloorchemische industrie..
Van al het geproduceerde elementair chloor wordt ongeveer 63% gebruikt bij de vervaardiging van organische verbindingen, 18% bij de vervaardiging van anorganische chloorverbindingen en de resterende 19% van het geproduceerde chloor wordt gebruikt voor bleekmiddelen en desinfectieproducten..

Tot de belangrijkste organische verbindingen in termen van productievolume behoren onder meer 1,2-dichloorethaan en vinylchloride (tussenproducten bij de productie van PVC), methylchloride, methyleenchloride, chloroform, vinylideenchloride..
De belangrijkste anorganische verbindingen zijn onder meer HCl, Cl2O, HOCl, NaClO3, AlCl3, SiCl4, SnCl4, PCl3, PCl5, POCl3, AsCl3, SbCl3, SbCl5, BiCl3, S2Cl2, SCl2, SOCI2, ClF3, ICl, ICl3, MoCl3, TiCl4, , ZnCl2 en nog veel meer.
Chloorgas wordt gebruikt bij industriële bleekoperaties, afvalwaterzuivering, de vervaardiging van tabletten voor de chlorering van zwembaden of bij chemische oorlogsvoering.
Chloorgas (bekend als bertholiet), werd voor het eerst gebruikt als wapen in de Eerste Wereldoorlog door Duitsland.
Na het eerste gebruik gebruikten beide partijen in het conflict chloor als chemisch wapen, maar het werd al snel vervangen door fosgeen en mosterdgas, die dodelijker zijn..
Chloorgas werd ook gebruikt tijdens de oorlog in Irak in de provincie Anbar in 2007.
Klinische effecten
Chloorgas is een van de meest voorkomende irriterende blootstellingen bij enkelvoudige inademing op het werk en in de omgeving. Recente studies hebben gemeld dat het mengsel van bleekmiddel (bleekmiddel, voornamelijk gemaakt op basis van natriumhypochloriet) met andere schoonmaakproducten, de meest voorkomende oorzaak is (21% van de gevallen) van eenmalige inademing, gerapporteerd in antigifcentra. Uit de Verenigde Staten.
De belangrijkste toxische effecten zijn eerder het gevolg van lokale weefselschade dan van systemische absorptie. Aangenomen wordt dat celbeschadiging het gevolg is van oxidatie van functionele groepen op cellulaire componenten; op reacties met water in weefsels om hypochloorzuur en zoutzuur te vormen; en het genereren van vrije zuurstofradicalen (hoewel dit idee nu controversieel is).
Bij lichte tot matige intoxicatie zijn er: hoesten, kortademigheid, pijn op de borst, branderig gevoel in de keel en in het retrosternale gebied, misselijkheid of braken, oog- en neusirritatie, verstikking, spierzwakte, duizeligheid, buikklachten en hoofdpijn.
Bij ernstige vergiftiging is er: oedeem van de bovenste luchtwegen, laryngospasme, ernstig longoedeem, longontsteking, aanhoudende hypoxemie, ademhalingsfalen, acuut longletsel en metabole acidose.
Chronische blootstelling aan chloorgas is een van de meest voorkomende oorzaken van beroepsastma. Het kan dyspnoe, hartkloppingen, pijn op de borst, reactief disfunctiesyndroom van de bovenste luchtwegen, erosie van tandglazuur en een verhoogde prevalentie van virale syndromen veroorzaken. Chronische blootstelling aan 15 ppm veroorzaakt hoesten, bloedspuwing, pijn op de borst en keelpijn.
Blootstelling van de huid kan huiderytheem, pijn, irritatie en brandwonden veroorzaken. Ernstige blootstelling kan cardiovasculaire collaps en ademhalingsstilstand veroorzaken. In hoge concentraties kan syncope en bijna onmiddellijke dood optreden. Chloor (als hypochloriet) is teratogeen bij proefdieren.
Veiligheid en risico's
Gevarenaanduidingen van het wereldwijd geharmoniseerde systeem voor de classificatie en etikettering van chemicaliën (GHS).
Het Globally Harmonized System of Classification and Labelling of Chemicals (GHS) is een internationaal overeengekomen systeem, gecreëerd door de Verenigde Naties, ontworpen om de verschillende classificatie- en etiketteringsnormen die in verschillende landen worden gebruikt te vervangen door consistente criteria op mondiaal niveau te gebruiken (Nations United, 2015 ).
De gevarenklassen (en hun overeenkomstige GHS-hoofdstuk), classificatie- en etiketteringsnormen en aanbevelingen voor chloorgas zijn als volgt (European Chemicals Agency, 2017; United Nations, 2015; PubChem, 2017):
GHS-gevarenklassen
H270: Kan brand veroorzaken of bevorderen; Oxidatiemiddel [Gevaar Oxiderende gassen - Categorie 1]
H280: Bevat gas onder druk; Kan ontploffen bij verhitting [Waarschuwing gassen onder druk - samengeperst gas, vloeibaar gas, opgelost gas]
H315: Veroorzaakt huidirritatie [Waarschuwing Huidcorrosie / -irritatie - Categorie 2]
H319: Veroorzaakt ernstige oogirritatie [Waarschuwing Ernstig oogletsel / oogirritatie - Categorie 2A]
H330: Dodelijk bij inademing [Gevaar Acute toxiciteit, inademing - Categorie 1, 2]
H331: Giftig bij inademing [Gevaar Acute toxiciteit, inademing - Categorie 3]
H335: Kan irritatie van de luchtwegen veroorzaken [Waarschuwing Specifieke doelorgaantoxiciteit bij eenmalige blootstelling; Irritatie van de luchtwegen - Categorie 3]
H400: Zeer giftig voor in het water levende organismen [Waarschuwing Gevaarlijk voor het aquatisch milieu, acuut gevaar - Categorie 1]
H410: Zeer vergiftig voor in het water levende organismen, met langdurige gevolgen [Waarschuwing Gevaarlijk voor het aquatisch milieu, gevaar op lange termijn - Categorie 1]
(PubChem, 2017)
Codes voor voorzorgsmaatregelen
P220, P244, P260, P261, P264, P271, P273, P280, P284, P302 + P352, P304 + P340, P305 + P351 + P338, P310, P311, P312, P320, P321, P332 + P313, P337 + P313, P362, P370 + P376, P391, P403, P403 + P233, P405, P410 + P403 en P501.
Referenties
- Benjah-bmm27 (2007). Dichloorgas-3D-vdW [afbeelding]. Hersteld van: commons.wikimedia.org.
- Bundesarchiv (1915). Deutsche Soldaten versprühen künstlichen Nebel [afbeelding]. Hersteld van: commons.wikimedia.org.
- ChemIDplus (2017) 3D-structuur van 7782-50-5 - Chloor [afbeelding] Hersteld van: chem.nlm.nih.gov.
- Nationale Oceanic and Atmospheric Administration (NOAA). CAMEO Chemicals. (2017). Reactive Group Datasheet. Oxiderende middelen, sterk. Silver Spring, MD. EU; Hersteld van: cameochemicals.noaa.gov.
- Oelen, W., (2005). Chloorgas in een fles [afbeelding]. Hersteld van: commons.wikimedia.org.
- Sargent, J., (1918). Vergast [afbeelding]. Hersteld van: en.wikipedia.org.
- Tomia (2006). Plastic-recycle-03 [afbeelding]. Hersteld van: commons.wikimedia.org.
- Wikipedia (2017). Chloor. Hersteld van: en.wikipedia.org.


Niemand heeft nog op dit artikel gereageerd.