
Chloorbenzeen (C6H5Cl) Structuur, eigenschappen, synthese
De chloorbenzeen is een aromatische verbinding met chemische formule C.6H.5Cl, in het bijzonder een aromatisch halogenide. Bij kamertemperatuur is het een kleurloze, brandbare vloeistof, die vaak wordt gebruikt als oplosmiddel en ontvetter. Bovendien dient het als grondstof voor de vervaardiging van talrijke zeer nuttige chemische verbindingen..
In de vorige eeuw diende het als basis voor de synthese van het insecticide DDT, zeer nuttig bij de uitroeiing van ziekten zoals malaria. In 1970 werd het gebruik ervan echter verboden vanwege de hoge toxiciteit voor mensen. Het chloorbenzeenmolecuul is polair vanwege een hogere elektronegativiteit van chloor in verhouding tot het koolstofatoom waaraan het bindt.
Dit resulteert in chloor met een matige dichtheid van negatieve lading δ- met betrekking tot koolstof en de rest van de aromatische ring. Evenzo is chloorbenzeen praktisch onoplosbaar in water, maar het is oplosbaar in vloeistoffen van aromatische chemische aard, zoals: chloroform, benzeen, aceton, enz..
Bovendien is Rhodococus phenolicus een bacteriesoort die chloorbenzeen als enige koolstofbron kan afbreken..
Artikel index
- 1 Chemische structuur
- 2 Chemische eigenschappen
- 2.1 Geur
- 2.2 Molecuulgewicht
- 2.3 Kookpunt
- 2.4 Smeltpunt
- 2.5 Vlampunt
- 2.6 Oplosbaarheid in water
- 2.7 Oplosbaarheid in organische verbindingen
- 2.8 Dichtheid
- 2.9 Dampdichtheid
- 2.10 Dampspanning
- 2.11 Zelfontbranding
- 2.12 Viscositeit
- 2.13 Corrosiviteit
- 2.14 Verbrandingswarmte
- 2.15 Verdampingswarmte
- 2.16 Oppervlaktespanning
- 2.17 Ionisatiepotentieel
- 2.18 Geurdrempelwaarde
- 2.19 Experimenteel vriespunt
- 2.20 Stabiliteit
- 3 Synthese
- 4 Toepassingen
- 4.1 Gebruikt in organische synthese
- 4.2 Toepassingen voor synthese van organische oplosmiddelen
- 4.3 Medicinale toepassingen
- 5 referenties
Chemische structuur
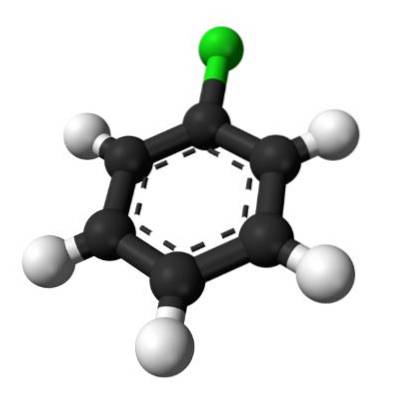
De bovenste afbeelding illustreert de structuur van chloorbenzeen. De zwarte koolstofbollen vormen de aromatische ring, terwijl de witte bollen en de groene bollen de waterstof- en chlooratomen vormen, dienovereenkomstig.
In tegenstelling tot het benzeenmolecuul heeft chloorbenzeen een dipoolmoment. Dit komt omdat het Cl-atoom elektronegatiever is dan de rest van de sp-gehybridiseerde koolstofatomen.twee.
Om deze reden is er geen uniforme verdeling van elektronendichtheid in de ring, maar het meeste is gericht op het Cl-atoom..
Volgens deze uitleg zou met een elektronendichtheidskaart kunnen worden bevestigd dat, hoewel zwak, er een gebied is dat δ rijk is aan elektronen..
Bijgevolg interageren chloorbenzeenmoleculen met elkaar door middel van dipool-dipoolkrachten. Ze zijn echter niet sterk genoeg om deze verbinding bij kamertemperatuur in de vaste fase te laten bestaan; daarom is het een vloeistof (maar met een hoger kookpunt dan benzeen).
Chemische eigenschappen
Geur
De geur is mild, niet onaangenaam en lijkt op amandel.
Molecuulgewicht
112,556 g / mol.
Kookpunt
131,6 ° C (270 ° F) bij een druk van 760 mmHg.
Smeltpunt
-45,2 ºC (-49 ºF)
Vlampunt
27 ºC (82 ºF)
Oplosbaarheid in water
499 mg / l bij 25 ºC.
Oplosbaarheid in organische verbindingen
Het is mengbaar met ethanol en ethylether. Het is zeer oplosbaar in benzeen, tetrachloorkoolstof, chloroform en zwavelkoolstof.
Dichtheid
1,1058 g / cm3 bij 20 ° C (1,11 g / cm3 bij 68 ° F). Het is een vloeistof die iets dichter is dan water.
Dampdichtheid
3.88 ten opzichte van lucht. 3,88 (lucht = 1).
Dampdruk
8,8 mmHg bij 68 ° F; 11,8 mmHg bij 77 ° F; 120 mmHg bij 25 ºC.
Zelfontbranding
593 ºC (1,099 ºC)
Viscositeit
0,806 mPoise bij 20 ºC.
Corrosiviteit
Tast sommige soorten kunststoffen, rubbersoorten en sommige soorten coatings aan.
Verbrandingswarmte
-3.100 kJ / mol bij 25 ºC.
Warmte van verdamping
40,97 kJ / mol bij 25 ºC.
Oppervlaktespanning
33,5 dyne / cm bij 20 ° C.
Ionisatiepotentieel
9,07 eV.
Geurdrempel
Herkenning in lucht 2.1.10-1 ppm. Weinig geur: 0,98 mg / cm3; sterke geur: 280 mg / cm3.
Experimenteel vriespunt
-45,55 ° C (-50 ° F).
Stabiliteit
Het is onverenigbaar met oxidatiemiddelen.
Synthese
In de industrie wordt de in 1851 geïntroduceerde methode gebruikt, waarbij chloorgas (Cltwee) door de vloeibare benzeen bij een temperatuur van 240 ºC in aanwezigheid van ferrichloride (FeCl3), die als katalysator fungeert.
C6H.6 => C6H.5Cl
Chloorbenzeen wordt ook bereid uit aniline in de Sandmayer-reactie. Aniline vormt benzeendiazoniumchloride in aanwezigheid van natriumnitriet; en benzeendiazoniumchloride vormt benzeenchloride in aanwezigheid van koperchloride.
Toepassingen
Gebruikt in organische synthese
-Het wordt gebruikt als oplosmiddel, ontvettingsmiddel en dient als grondstof voor de bereiding van talrijke zeer nuttige verbindingen. Chloorbenzeen werd gebruikt bij de synthese van het insecticide DDT, dat momenteel niet wordt gebruikt vanwege zijn giftigheid voor de mens.
-Hoewel in mindere mate chloorbenzeen wordt gebruikt bij de synthese van fenol, een verbinding die een fungicide, bacteriedodende, insecticide, antiseptische werking heeft en ook wordt gebruikt bij de productie van landbouwchemicaliën, evenals bij het productieproces van aceetisalicylzuur..
-Het is betrokken bij de vervaardiging van diisocyanaat, een ontvettingsmiddel voor auto-onderdelen.
-Het wordt gebruikt om p-nitrochloorbenzeen en 2,4-dinitrochloorbenzeen te verkrijgen.
-Het wordt gebruikt bij de synthese van de verbindingen trifenylfosfine, thiofenol en fenylsilaan.
-Trifenylfosfine wordt gebruikt bij de synthese van organische verbindingen; thiofenol is een pesticide middel en farmaceutisch tussenproduct. In plaats daarvan wordt fenylsilaan gebruikt in de siliconenindustrie.
-Het maakt deel uit van de grondstof voor de vervaardiging van difenyloxide, dat wordt gebruikt als warmteoverdrachtsmiddel, bij de bestrijding van plantenziekten en bij de vervaardiging van andere chemische producten..
-Het uit chloorbenzeen verkregen p-nitrochloorbenzeen is een verbinding die wordt gebruikt als tussenproduct bij de vervaardiging van kleurstoffen, pigmenten, geneesmiddelen (paracetamol) en in de rubberchemie.
Gebruikt voor synthese van organische oplosmiddelen
Chloorbenzeen wordt ook gebruikt als grondstof voor de vervaardiging van oplosmiddelen die worden gebruikt bij de synthesereacties van organische verbindingen, zoals methyleendifenyldiisocyanaat (MDI) en urethaan..
MDI is betrokken bij de synthese van polyurethaan, dat tal van functies vervult bij de productie van bouwproducten, koelkasten en diepvriezers, bedmeubels, schoenen, auto's, coatings en kleefstoffen en andere toepassingen.
Evenzo is urethaan een grondstof voor de productie van hulpstoffen voor de landbouw, verf, inkt en reinigingsoplosmiddelen voor gebruik in elektronica..
Medisch gebruik
-2,4-dinitrochloorbenzeen is in de dermatologie gebruikt bij de behandeling van alopecia areata. Het is ook gebruikt in allergiestudies en in de immunologie van dermatitis, vitiligo en bij de prognose van de evolutie bij patiënten met kwaadaardig melanoom, genitale wratten en gewone wratten..
-Het is therapeutisch gebruikt bij patiënten met hiv. Aan de andere kant zijn er immunomodulerende functies aan toegekend, een aspect dat ter discussie staat..
Referenties
- Dra. Alessandra B. Alió S. (1998). Dinitrochloorbenzeen en zijn toepassingen. [Pdf]. Venezolaanse dermatologie, VOL. 36, nr. 1.
- Panoli Intermediates India Private Limited. Para-nitrochloorbenzeen (PNCB). Opgehaald op 4 juni 2018, van: panoliindia.com
- Korry Barnes. (2018). Chloorbenzeen: eigenschappen, reactiviteit en gebruik. Opgehaald op 4 juni 2018, van: study.com
- Wikipedia. (2018). Chloorbenzeen. Opgehaald op 4 juni 2018, van: en.wikipedia.org
- PubChem. (2018). Chloorbenzeen. Opgehaald op 4 juni 2018, van: pubchem.ncbi.nlm.nih.gov


Niemand heeft nog op dit artikel gereageerd.