
Chroomchloride (CrCl3) structuur, eigenschappen, gebruik
De chroomchloride (CrCl3 is een anorganisch zout dat is samengesteld uit Cr-kationen3+ en Cl-anionen- in een verhouding van 1: 3; dat wil zeggen, voor elke Cr3+ er zijn drie Cl-. Zoals later zal worden gezien, zijn hun interacties niet ionisch. Dit zout kan in twee vormen worden aangeboden: watervrij en hexahydraat..
De watervrije vorm wordt gekenmerkt door een roodachtig violette kleur; terwijl het hexahydraat, CrCl3.6HtweeOf het is donkergroen. De opname van de watermoleculen wijzigt de fysische eigenschappen van genoemde kristallen; zoals hun kook- en smeltpunten, dichtheden, enz..

Chroom (III) chloride (volgens de voorraadnomenclatuur) ontleedt bij hoge temperaturen en wordt omgezet in chroom (II) chloride, CrCltwee. Het is corrosief voor metalen, hoewel het wordt gebruikt bij het verchromen: een procedure waarbij metalen worden gecoat met een dunne laag chroom.
De cr3+, Het komt uit zijn respectievelijke chloride en is gebruikt bij de behandeling van diabetes, vooral bij patiënten met totale parenterale voeding (TPN), die niet de vereiste hoeveelheid chroom binnenkrijgen. De resultaten zijn echter veel beter (en betrouwbaarder) indien geleverd als picolinaat..
Artikel index
- 1 Structuur van chroomchloride
- 1.1 Kristallijne lagen watervrij
- 2 Eigenschappen
- 2.1 Namen
- 2.2 Chemische formule
- 2.3 Molecuulgewicht
- 2.4 Fysieke beschrijving
- 2.5 Smeltpunt
- 2.6 Kookpunt
- 2.7 Oplosbaarheid in water
- 2.8 Oplosbaarheid in organische oplosmiddelen
- 2.9 Dichtheid
- 2.10 Opslagtemperatuur
- 2.11 Ontleding
- 2.12 Corrosie
- 2.13 Reacties
- 2,14 pH
- 3 Synthese
- 4 toepassingen
- 4.1 Industrieel
- 4.2 Therapeutica
- 5 Risico's
- 6 referenties
Chroomchloride-structuur
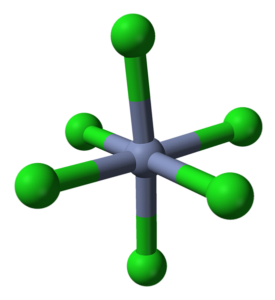
De CrCl3 Ondanks dat het een zout is, is de aard van zijn interacties niet puur ionisch; een bepaald covalent karakter hebben, product van de coördinatie tussen Cr3+ en Cl-, die aanleiding geven tot een vervormde octaëder (bovenste afbeelding). Chroom bevindt zich in het midden van de octaëder en chloor in zijn hoekpunten.
De octaëder CrCl6 kan op het eerste gezicht in tegenspraak zijn met de CrCl-formule3deze complete octaëder definieert echter niet de eenheidscel van het kristal, maar eerder een kubus (ook vervormd), die de groene bollen of chlooranionen doormidden snijdt.
Watervrije kristallijne lagen
De eenheidscel met deze octaëder behoudt dus nog steeds de verhouding van 1: 3. Door deze vervormde kubussen in de ruimte te reproduceren, wordt het CrCl-kristal verkregen3, die in de bovenste afbeelding wordt weergegeven met een driedimensionaal vulmodel en een model van bollen en balken.

Deze kristallijne laag is een van de vele die de schilferige roodviolette kristallen van CrCl vormen.3 (verwar de kleur van het kristal niet met die van de groene bollen).
Zoals te zien is, zijn de anionen Cl- ze bezetten het oppervlak, dus stoten hun negatieve ladingen de andere kristallijne lagen af. Bijgevolg worden de kristallen schilferig en broos; maar glanzend, vanwege het chroom.
Als dezelfde lagen worden gevisualiseerd vanuit een lateraal perspectief, zal in plaats van octaëders, vervormde tetraëders worden waargenomen:
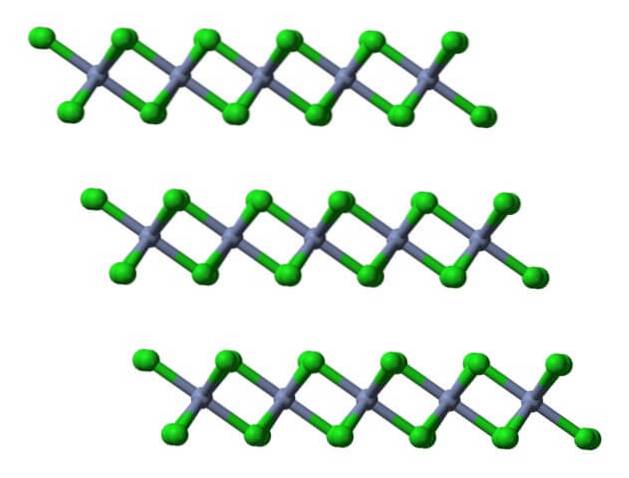
Hier wordt het verder vergemakkelijkt om te begrijpen waarom de lagen elkaar afstoten wanneer Cl-anionen binden.- van hun oppervlakken.
Eigendommen
Namen
-Chroom (III) chloride
-Chroom (III) trichloride
-Chroom (III) chloride, watervrij.
Chemische formule
-CrCl3 (watervrij).
-CrCl3.6HtweeO (hexahydraat).
Molecuulgewicht
-158,36 g / mol (watervrij).
-266,43 g / mol (hexahydraat).
Fysieke beschrijving
-Roodachtig-violette vaste stoffen en kristallen (watervrij).
-Donkergroen kristallijn poeder (hexahydraat, onderste afbeelding). In dit hydraat is te zien hoe water glans remt, een metallische eigenschap van chroom.

Smeltpunt
-1.152 ºC (2.106 ºF, 1.425 K) (watervrij)
-83 ºC (hexahydraat).
Kookpunt
1300 ° C (2370 ° F, 1570) (watervrij).
Oplosbaarheid in water
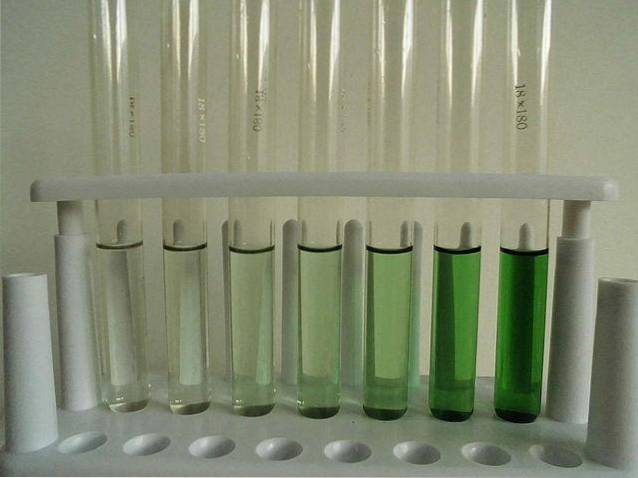
-Enigszins oplosbaar (watervrij).
-585 g / l (hexahydraat).
De afbeelding hierboven toont een reeks reageerbuizen gevuld met een waterige oplossing van CrCl3. Merk op dat hoe geconcentreerder het is, hoe intenser de kleur van het complex [Cr (OHtwee63+, verantwoordelijk voor de groene kleur.
Oplosbaarheid in organische oplosmiddelen
Oplosbaar in ethanol, maar onoplosbaar in ether (watervrij).
Dichtheid
-2,87 gr / cm3 (watervrij).
-2,76 g / cm3 (hexahydraat).
Bewaar temperatuur
Ontleding
Bij verhitting tot ontbinding geeft chroom (III) chloride giftige dampen van chloorhoudende verbindingen af. Deze verbindingen komen ook vrij wanneer chroom (III) chloride in contact komt met sterke zuren..
Corrosie
Het is zeer corrosief en kan bepaalde staalsoorten aantasten.
Reacties
Het is onverenigbaar met sterk oxiderende stoffen. Het reageert ook sterk met lithium en stikstof..
Bij verhitting in aanwezigheid van waterstof reduceert het tot chroom (II) chloride, waarbij waterstofchloride wordt gevormd.
2 CrCl3 + H.twee => 2 CrCltwee + 2 HCl
pH
In een waterige oplossing en met een concentratie van 0,2 M: 2,4.
Synthese
Chroom (III) chloride-hexahydraat wordt geproduceerd door chroomhydroxide te laten reageren met zoutzuur en water.
Cr (OH)3 + 3 HCl + 3 HtweeO => CrCl3.6HtweeOF
Om vervolgens het watervrije zout te verkrijgen, wordt de CrCl verwarmd3.6HtweeOf in aanwezigheid van thionylchloride, SOCltwee, zoutzuur en warmte:
[Cr (HtweeOF)6] Cl3 + 6SOCltwee + ∆ → CrCl3 + 12 HCl + 6SOtwee
Als alternatief kan CrCl3 verkregen door chloorgas over een mengsel van chroom en koolstofoxide te leiden.
CrtweeOF3 + 3 C + Cltwee => 2 CrCl3 + 3 CO
En tot slot, de meest gebruikte methode, is het om zijn oxide te verwarmen met een halogeneringsmiddel, zoals tetrachloorkoolstof:
CrtweeOF3 + 3CCl4 + ∆ → 2CrCl3 + 3COCltwee
Toepassingen
Industrieel
Chroomchloride is betrokken bij de in situ bereiding van chroom (II) chloride; reagens betrokken bij de reductie van alkylhalogeniden en bij de synthese van (E) -alkenylhalogeniden.
-Het wordt gebruikt bij de verchroomtechniek. Deze bestaat uit het door galvaniseren van een dun laagje chroom op metalen voorwerpen of ander materiaal met een decoratief objectief af te zetten, waardoor de corrosiebestendigheid en ook de oppervlaktehardheid toeneemt..
-Het wordt gebruikt als bijtmiddel voor textiel en dient als schakel tussen het verfmateriaal en de te verven weefsels. Bovendien wordt het gebruikt als katalysator voor de productie van olefinen en waterdichtmakende middelen..
Therapeutica
Het gebruik van USP-chroomchloridesupplement wordt aanbevolen bij patiënten die alleen intraveneuze oplossingen krijgen, toegediend voor totale parenterale voeding (TPN). Daarom alleen als deze patiënten niet al hun voedingsbehoeften krijgen.
Chroom (III) maakt deel uit van de glucosetolerantiefactor, een activator van insulinebevorderende reacties. Chroom (III) wordt verondersteld het glucose-, eiwit- en lipidenmetabolisme te activeren, waardoor de werking van insuline bij mens en dier wordt vergemakkelijkt.
Chroom is in veel voedingsmiddelen aanwezig. Maar de concentratie is niet hoger dan 2 per portie, waarbij broccoli het voedsel is met de hoogste bijdrage (11 µg). Bovendien is de opname van chroom in de darm laag, met een waarde van 0,4 tot 2,5% van de ingenomen hoeveelheid..
Dit maakt het moeilijk om een dieet voor de aanvoer van chroom vast te stellen. In 1989 adviseerde de National Academy of Sciences 50 tot 200 µg / dag als een adequate inname van chroom..
Risico's
Een van de mogelijke risico's van het consumeren van dit zout als chroomsupplement zijn:
-Ernstige buikpijn.
-Abnormale bloeding, die kan variëren van moeite met het genezen van een wond, rodere blauwe plekken of donker worden van de ontlasting door inwendige bloedingen.
-Irritaties in het spijsverteringsstelsel, waardoor maagzweren of darmen ontstaan.
-Dermatitis
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). Mc Graw Hill.
- Wikipedia. (2019). Chroom (III) chloride. Hersteld van: en.wikipedia.org
- Chroom (III) Chloride [PDF]. Hersteld van: alpha.chem.umb.edu
- PubChem. (2019). Chroomchloride-hexahydraat. Hersteld van: pubchem.ncbi.nlm.nih.gov
- National Institutes of Health. (21 september 2018). Chroom: informatieblad voedingssupplementen. Hersteld van: ods.od.nih.gov
- Tomlinson Carole A. (2019). Bijwerkingen van chroomchloride. Leaf Group Ltd. Hersteld van: healthfully.com



Niemand heeft nog op dit artikel gereageerd.