
Elektrolytische celdelen, hoe het werkt en toepassingen
De elektrolytische cel het is een medium waar energie of een elektrische stroom wordt gebruikt om een niet-spontane oxidatiereductiereactie uit te voeren. Het bestaat uit twee elektroden: de anode en de kathode.
Aan de anode (+) vindt oxidatie plaats, aangezien op deze plaats sommige elementen of verbindingen elektronen verliezen; terwijl in de kathode (-), de reductie, omdat daarin sommige elementen of verbindingen elektronen winnen.
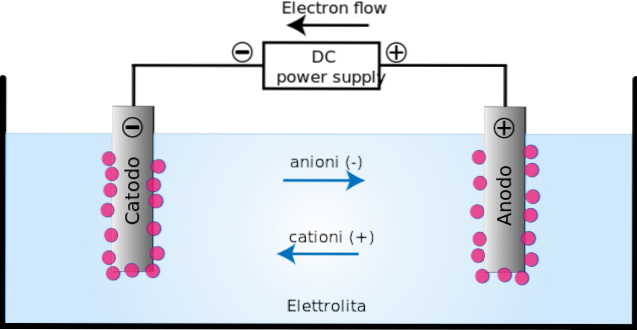
In de elektrolytische cel vindt de afbraak van sommige stoffen, die eerder geïoniseerd waren, plaats via een proces dat bekend staat als elektrolyse..
Door het aanleggen van de elektrische stroom ontstaat er een oriëntatie in de beweging van de ionen in de elektrolytische cel. Positief geladen ionen (kationen) migreren naar de oplaadkathode (-).
Ondertussen migreren de negatief geladen ionen (anionen) naar de geladen anode (+). Deze ladingsoverdracht vormt een elektrische stroom (bovenste afbeelding). In dit geval wordt de elektrische stroom geleid door elektrolytoplossingen die aanwezig zijn in de elektrolytische celhouder..
De wet van Faraday van elektrolyse stelt dat de hoeveelheid stof die oxidatie of reductie ondergaat bij elke elektrode recht evenredig is met de hoeveelheid elektriciteit die door de cel of cel gaat..
Artikel index
- 1 onderdelen
- 2 Hoe werkt een elektrolytische cel?
- 2.1 Elektrolyse van gesmolten natriumchloride
- 2.2 Down Cell
- 3 Toepassingen
- 3.1 Industriële syntheses
- 3.2 Coating en raffinage van metalen
- 4 referenties
Onderdelen
Een elektrolytische cel bestaat uit een houder waarin het materiaal wordt afgezet dat de reacties ondergaat die worden veroorzaakt door de elektrische lading..
De container heeft een paar elektroden die zijn aangesloten op een gelijkstroombatterij. De elektroden die gewoonlijk worden gebruikt, zijn gemaakt van een inert materiaal, dat wil zeggen dat ze niet deelnemen aan de reacties.
Een ampèremeter kan in serie met de batterij worden aangesloten om de intensiteit van de stroom die door de elektrolytoplossing vloeit te meten. Evenzo wordt een voltmeter parallel geplaatst om het spanningsverschil tussen het paar elektroden te meten..
Hoe werkt een elektrolytische cel??
Elektrolyse van gesmolten natriumchloride
Het verdient de voorkeur om gesmolten natriumchloride te gebruiken boven vast natriumchloride, aangezien dit laatste geen elektriciteit geleidt. Ionen trillen in je kristallen, maar ze zijn niet vrij om te bewegen.
Kathode reactie
Elektroden van grafiet, een inert materiaal, zijn verbonden met de accupolen. Een elektrode is verbonden met de positieve pool van de batterij en vormt de anode (+).
Ondertussen is de andere elektrode verbonden met de negatieve pool van de batterij en vormt deze de kathode (-). Als er stroom uit de batterij vloeit, wordt het volgende in acht genomen:
Aan de kathode (-) is er een reductie van het Na-ion+, die bij het verkrijgen van een elektron worden omgezet in metallisch Na:
Na+ + en- => Na (l)
Zilverachtig wit metallisch natrium drijft bovenop gesmolten natriumchloride.
Anode reactie
Integendeel, de oxidatie van het Cl-ion vindt plaats aan de anode (+)-, omdat het elektronen verliest en chloorgas wordt (Cltwee), een proces dat zich manifesteert door het verschijnen aan de anode van een bleekgroen gas. De reactie die optreedt bij de anode kan als volgt worden geschetst:
2Cl- => Cltwee (g) + 2 e-
De vorming van metallisch Na- en Cl-gastwee van NaCl is het geen spontaan proces, waarvoor temperaturen hoger dan 800 ° C nodig zijn om het te laten plaatsvinden. De elektrische stroom levert de energie zodat de aangegeven transformatie plaatsvindt aan de elektroden van de elektrolytische cel..
Elektronen worden verbruikt aan de kathode (-) in het reductieproces en worden geproduceerd aan de anode (+) tijdens oxidatie. Daarom stromen elektronen door het externe circuit van de elektrolytische cel van anode naar kathode..
De gelijkstroombatterij levert de energie voor de elektronen om niet-spontaan van de anode (+) naar de kathode (-) te stromen.
Beneden Cell
De Down-cel is een aanpassing van de elektrolytische cel die is beschreven en wordt gebruikt voor de industriële productie van metallisch Na en chloorgas..
De elektrolytische cel van Down heeft apparaten waarmee metallisch natrium- en chloorgas afzonderlijk kunnen worden opgevangen. Deze productiemethode van metallisch natrium is nog steeds erg praktisch.
Eenmaal vrijgegeven door elektrolyse, wordt het vloeibare metallische natrium afgevoerd, gekoeld en in blokken gesneden. Vervolgens wordt het opgeslagen in een inert medium, aangezien natrium explosief kan reageren bij contact met water of zuurstof uit de lucht..
Chloorgas wordt in de industrie voornamelijk geproduceerd door de elektrolyse van natriumchloride in een goedkoper proces dan de productie van metallisch natrium.
Toepassingen
Industriële syntheses
-In de industrie worden elektrolytische cellen gebruikt bij het elektrolytisch raffineren en galvaniseren van verschillende non-ferrometalen. Bijna al het zeer zuivere aluminium, koper, zink en lood worden industrieel geproduceerd in elektrolytische cellen..
-Waterstof wordt geproduceerd door elektrolyse van water. Deze chemische procedure wordt ook gebruikt bij het verkrijgen van zwaar water (D.tweeOF).
-Metalen zoals Na, K en Mg worden verkregen door elektrolyse van gesmolten elektrolyten. Ook worden niet-metalen zoals fluoriden en chloriden verkregen door elektrolyse. Ook verbindingen zoals NaOH, KOH, NatweeCO3 en KMnO4 worden volgens dezelfde procedure gesynthetiseerd.
Coaten en verfijnen van metalen
-Het proces van het coaten van een inferieur metaal met een metaal van hogere kwaliteit staat bekend als galvaniseren. Het doel hiervan is om corrosie van het onderste metaal te voorkomen en aantrekkelijker te maken. Voor dit doel worden elektrolytische cellen gebruikt bij het galvaniseren..
-Onzuivere metalen kunnen worden gezuiverd door elektrolyse. In het geval van koper worden zeer dunne metaalplaten op de kathode geplaatst en grote staven onzuiver koper om te worden verfijnd op de anode.
-Het gebruik van gefineerde items is gebruikelijk in de samenleving. Sieraden en tafelgerei zijn meestal verzilverd; goud wordt elektrolytisch afgezet op sieraden en elektrische contacten. Veel objecten zijn voor decoratieve doeleinden bedekt met koper.
-Auto's hebben chromen stalen spatborden en andere onderdelen. Het verchromen van een autobumper vergt slechts 3 seconden verchromen om een 0,0002 mm dik glanzend oppervlak te produceren.
-Door de snelle elektrodepositie van metaal ontstaan ruwe, zwarte oppervlakken. Langzame elektrodepositie zorgt voor gladde oppervlakken. De "blikjes" zijn gemaakt van staal dat door elektrolyse met tin is bekleed. Soms worden deze blikken in een fractie van een seconde verchroomd met de dikte van de extreem dunne chroomlaag.
Referenties
- Whitten, Davis, Peck & Stanley. Chemie. (8e ed.). CENGAGE Leren.
- eMedical Prep. (2018). Toepassingen van elektrolyse. Hersteld van: emedicalprep.com
- Wikipedia. (2018). Elektrolytische cel. Hersteld van: en.wikipedia.org
- Prof. Shapley P. (2012). Galvanische en elektrolytische cellen. Hersteld van: butane.chem.uiuc.edu
- Bodner Research Web. (s.f.). Elektrolytische cellen. Hersteld van: chemed.chem.purdue.edu



Niemand heeft nog op dit artikel gereageerd.