
Samendrukbaarheid van vaste stoffen, vloeistoffen, gassen, voorbeelden
De samendrukbaarheid van een stof of materiaal is de verandering in volume die het ervaart wanneer het wordt onderworpen aan een verandering in druk. Over het algemeen neemt het volume af wanneer er druk op een systeem of object wordt uitgeoefend. Soms gebeurt echter het tegenovergestelde: een verandering in druk kan een explosie veroorzaken waarbij het systeem in volume toeneemt of wanneer er een faseverandering plaatsvindt..
Bij sommige chemische reacties kan dit gebeuren en ook in gassen, aangezien naarmate de frequentie van botsingen toeneemt, de afstotende krachten optreden..

Als je je voorstelt hoe gemakkelijk of moeilijk het kan zijn om een voorwerp samen te drukken, overweeg dan de drie toestanden waarin materie zich normaal bevindt: vast, vloeibaar en gasvormig. In elk van hen bewaren de moleculen bepaalde afstanden van elkaar. Hoe sterker de bindingen die de moleculen van de stof vormen waaruit het object bestaat en hoe dichter ze zijn, hoe moeilijker het zal zijn om een vervorming te veroorzaken.
Bij een vaste stof zijn de moleculen erg dicht bij elkaar, en als je ze dichter bij elkaar probeert te brengen, verschijnen afstotende krachten die de taak moeilijk maken. Daarom wordt gezegd dat vaste stoffen niet erg samendrukbaar zijn. In de moleculen van vloeistoffen is er meer ruimte, dus hun samendrukbaarheid is groter, maar toch vereist de volumeverandering meestal grote krachten.
Dus vaste stoffen en vloeistoffen zijn nauwelijks samendrukbaar. Er zou een zeer grote drukvariatie nodig zijn om een aanzienlijke volumeverandering te bereiken onder zogenaamde normale druk- en temperatuuromstandigheden. Aan de andere kant kunnen gassen, omdat hun moleculen ver uit elkaar staan, gemakkelijk worden gecomprimeerd en gedecomprimeerd.
Artikel index
- 1 Samendrukbaarheid van vaste stoffen
- 1.1 -Compressibiliteit van een materiaal
- 2 Opgeloste oefeningen-voorbeelden
- 2.1 - Opgeloste oefening 1
- 2.2 - Opgeloste oefening 2
- 2.3 - Opgeloste oefening 3
- 3 Samendrukbaarheid in gassen
- 3.1 - Opgeloste oefening 5
- 4 referenties
Solide samendrukbaarheid
Wanneer een object bijvoorbeeld in een vloeistof wordt ondergedompeld, wordt er in alle richtingen druk op het object uitgeoefend. Op deze manier kunnen we denken dat het volume van het object zal afnemen, hoewel dit in de meeste gevallen niet merkbaar zal zijn..
De situatie is te zien in de volgende figuur:
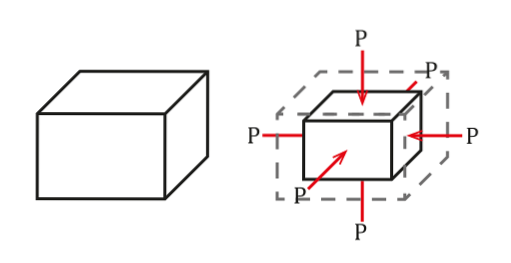
Druk wordt gedefinieerd als kracht per oppervlakte-eenheid, die een volumeverandering AV veroorzaakt evenredig met het aanvankelijke volume van het object Vof. Deze volumeverandering hangt af van de kwaliteiten ervan..
De wet van Hooke stelt dat de vervorming die een object ervaart evenredig is met de spanning die erop wordt uitgeoefend:
Stress ∝ Strain
De volumetrische vervorming die een lichaam ervaart, wordt gekwantificeerd door B de vereiste evenredigheidsconstante, die de volumetrische modulus van het materiaal
B = -Stress / Strain
B = -ΔP / (ΔV / Vof
Zoals AV / Vof is een dimensieloze grootheid, aangezien het het quotiënt is tussen twee volumes, heeft de volumetrische module dezelfde drukeenheden, die in het internationale systeem Pascals (Pa) zijn.
Het minteken geeft de verwachte volumevermindering aan, wanneer het object voldoende is gecomprimeerd, dat wil zeggen dat de druk toeneemt.
-Samendrukbaarheid van een materiaal
De omgekeerde of wederkerige waarde van de volumetrische modulus staat bekend als samendrukbaarheid en wordt aangegeven met de letter k. Daarom:

Hier k is het negatief van de fractionele volumeverandering per drukverhoging. De eenheden in het internationale systeem zijn de inverse van Pa, dat wil zeggen mtwee / N.
De vergelijking voor B of voor k, als u dat wilt, is van toepassing op zowel vaste stoffen als vloeistoffen. Het concept van volumetrische modulus wordt zelden toegepast op gassen. Een eenvoudig model om de volumeafname die een echt gas kan ervaren te kwantificeren, wordt hieronder uitgelegd..
De geluidssnelheid en de compressibiliteitsmodulus
Een interessante toepassing is de geluidssnelheid in een medium, die afhangt van de compressibiliteitsmodulus:

Opgeloste oefeningen-voorbeelden
-Opgeloste oefening 1
Een massief koperen bol met een volume van 0,8 m3 het wordt in de oceaan gedropt tot een diepte waar de hydrostatische druk 20 M Pa groter is dan aan de oppervlakte. Hoe verandert het volume van de bol? De compressibiliteitsmodulus van messing is bekend B = 35.000 MPa,
Oplossing
1 M Pa = 1 Mega Pascal = 1, 10 6 vader
De drukvariatie ten opzichte van het oppervlak is DP = 20 x 10 6 Pa. Als we de vergelijking voor B toepassen, hebben we:
B = -ΔP / (ΔV / Vof
Daarom:

AV = -5,71,10 -4 x 0,8 m3 = -4,57 x 10-4 m3
Het volumeverschil kan een negatief teken hebben als het uiteindelijke volume kleiner is dan het oorspronkelijke volume, daarom komt dit resultaat overeen met alle aannames die we tot nu toe hebben gedaan.
De zeer hoge compressibiliteitsmodulus geeft aan dat een grote drukverandering vereist is opdat het object een aanzienlijke afname in volume ervaart..
-Oefening opgelost 2
Door uw oor tegen het spoor te houden, kunt u zien wanneer een van deze voertuigen in de verte nadert. Hoe lang duurt het om op een stalen rail te reizen als de trein zich op 1 km afstand bevindt??
Gegevens
Staaldichtheid = 7,8 x 10 3 kg / m3
Stalen samendrukbaarheidsmodulus = 2,0 x 10 elf vader.
Oplossing

De hierboven berekende samendrukbaarheidsmodulus B is ook van toepassing op vloeistoffen, hoewel in het algemeen veel inspanning vereist is om een aanzienlijke afname van het volume te bewerkstelligen. Maar vloeistoffen kunnen uitzetten of krimpen als ze opwarmen of afkoelen, en evenzeer als ze drukloos of onder druk staan..
Voor water onder standaardomstandigheden van druk en temperatuur (0 ° C en één atmosfeer druk ongeveer of 100 kPa), is de volumetrische modulus 2100 MPa. Dat wil zeggen, ongeveer 21.000 keer de atmosferische druk.
Om deze reden worden vloeistoffen in de meeste toepassingen meestal als onsamendrukbaar beschouwd. Dit kan direct worden gecontroleerd met numerieke applicatie.
-Oefening opgelost 3
Zoek de fractionele afname van het watervolume wanneer het wordt blootgesteld aan een druk van 15 MPa.
Oplossing

Samendrukbaarheid in gassen
Gassen, zoals hierboven uitgelegd, werken een beetje anders.
Om te weten welk volume ze hebben n molen van een bepaald gas wanneer het onder een druk wordt ingesloten P. en op een temperatuur T, de toestandsvergelijking wordt gebruikt. In de toestandsvergelijking voor een ideaal gas, waarbij geen rekening wordt gehouden met intermoleculaire krachten, stelt het eenvoudigste model dat:
P.Videaal = n. R. T
Waarbij R de ideale gasconstante is.
Veranderingen in gasvolume kunnen worden uitgevoerd bij constante druk of constante temperatuur. Door bijvoorbeeld de temperatuur constant te houden, wordt de isotherme samendrukbaarheid ΚT het is:

In plaats van het symbool "delta" dat eerder werd gebruikt bij het definiëren van het concept voor vaste stoffen, wordt het voor een gas beschreven met een afgeleide, in dit geval een gedeeltelijke afgeleide met betrekking tot P, waarbij T constant wordt gehouden.
Daarom BT de isotherme samendrukbaarheidsmodulus is:

En de adiabatische compressibiliteitsmodulus B is ook belangrijk.adiabatisch, waarvoor er geen inkomende of uitgaande warmtestroom is.
Badiabatisch γp
Waar γ de adiabatische coëfficiënt is. Met deze coëfficiënt kan de geluidssnelheid in lucht worden berekend:

Gebruik de bovenstaande vergelijking om de geluidssnelheid in lucht te bepalen.
Gegevens
De adiabatische samendrukbaarheidsmodulus van lucht is 1,42 x 105 vader
De dichtheid van lucht is 1.225 kg / m3 (bij atmosferische druk en 15 ºC)
Oplossing

In plaats van te werken met de samendrukbaarheidsmodulus, als eenheidsveranderingen in volume per drukverandering, de samendrukbaarheidsfactor van een echt gas, een ander maar illustratief concept van hoe echt gas zich verhoudt tot ideaal gas:
P. V.echt = Z. R. T
Waar Z de samendrukbaarheidscoëfficiënt van het gas is, die afhangt van de omstandigheden waarin het wordt aangetroffen, in het algemeen een functie is van zowel de druk P als de temperatuur T, en kan worden uitgedrukt als:
Z = f (P, T)
In het geval van een ideaal gas is Z = 1. Voor echte gassen neemt de Z-waarde bijna altijd toe met de druk en neemt deze af met de temperatuur.
Naarmate de druk toeneemt, botsen de gasvormige moleculen vaker en nemen de afstotende krachten tussen hen toe. Dit kan leiden tot een volumetoename van het echte gas, waarbij Z> 1.
Bij lagere drukken daarentegen zijn de moleculen vrij om te bewegen en overheersen aantrekkingskrachten. In dat geval zal Z < 1.
Voor het eenvoudige geval van 1 mol gas n = 1, als dezelfde druk- en temperatuuromstandigheden worden gehandhaafd, krijgen we door de vorige vergelijkingen term per term te delen:

V.echt = Z Videaal
-Oefening opgelost 5
Er is een echt gas bij 250 ºK en 15 atm druk, dat een molair volume heeft dat 12% minder is dan berekend door de ideale gasvergelijking van de toestand. Als de druk en temperatuur constant worden gehouden, zoek dan naar:
a) De samendrukbaarheidsfactor.
b) Het molaire volume van het echte gas.
c) Welk soort krachten overheersen: aantrekkelijk of afstotend?
Oplossing
a) Als het werkelijke volume 12% minder is dan het ideaal, betekent dit dat:
V.echt = 0,88 Videaal
Daarom is voor 1 mol gas de samendrukbaarheidsfactor:
Z = 0,88
b) Het kiezen van de ideale gasconstante met de juiste eenheden voor de geleverde gegevens:
R = 0,082 L.atm / mol.K
Het molaire volume wordt berekend door waarden op te lossen en te vervangen:
c) Aantrekkelijke krachten overheersen, aangezien Z kleiner is dan 1.
Referenties
- Atkins, P. 2008. Fysische chemie. Redactioneel Médica Panamericana. 10 - 15.
- Giancoli, D. 2006. Natuurkunde: principes met toepassingen. 6th. Ed Prentice Hall. 242 - 243 en 314-15
- Mott, R. 2006. Vloeistofmechanica. Pearson Education 13-14.
- Rex, A. 2011. Fundamentals of Physics. Pearson Education. 242-243.
- Tipler, P. (2006) Fysica voor wetenschap en technologie. 5e Ed. Deel 1. Redactioneel Reverté. 542.


Niemand heeft nog op dit artikel gereageerd.