
Galvanische corrosiemechanismen, voorbeelden, bescherming
De galvanische of elektrochemische corrosie Het is een proces waarbij een metaal of legering sneller degradeert in vergelijking met de conventionele oxidatie. Men kan zeggen dat het een versnelde oxidatie is, en zelfs opzettelijk gesteund; zoals het gebeurt in cellen of batterijen.
Dit gebeurt onder een aantal voorwaarden. Ten eerste moet er een actief metaal zijn, de anode genaamd. Ook, en ten tweede, moet er een laag-reactief edelmetaal zijn dat de kathode wordt genoemd. De derde en vierde voorwaarden zijn de aanwezigheid van een medium waar elektronen zich voortplanten, zoals water, en ionsoorten of elektrolyten..

Galvanische corrosie is vooral waarneembaar in maritieme omgevingen of aan de oevers van stranden. Luchtstromen wekken massa's waterdamp op, die op hun beurt enkele ionen vervoeren; deze laatste blijven aan een dun laagje water of druppels die op het metalen oppervlak rusten.
Deze omstandigheden van vochtigheid en zoutgehalte bevorderen de corrosie van het metaal. Dat wil zeggen, een ijzeren kroon zoals die in de bovenstaande afbeelding zal sneller roesten als deze wordt blootgesteld aan de nabijheid van de zee..
Het gemak dat een metaal zal moeten oxideren in vergelijking met een ander, kan kwantitatief worden gemeten aan de hand van zijn reductiepotentieel; Scheikundeboeken staan vol tabellen met deze mogelijkheden E. Hoe negatiever het is, hoe groter de neiging tot roesten.
Evenzo, als dit metaal in de aanwezigheid is van een ander met een zeer positief reductiepotentieel, dus met een grote AE, zal de oxidatie van het reactieve metaal agressiever zijn. Andere factoren, zoals pH, ionsterkte, vochtigheid, de aanwezigheid van zuurstof en de relatie tussen de gebieden van het metaal dat wordt geoxideerd en dat wordt verminderd, zijn ook belangrijk..
Artikel index
- 1 Mechanismen
- 1.1 Concepten en reacties
- 1.2 Depolarisatoren
- 1.3 IJzercorrosie
- 2 voorbeelden
- 2.1 Anodische indexen
- 3 Bescherming tegen elektrochemische corrosie
- 3.1 Opofferingscoatings
- 3.2 Edele coatings
- 4 Experimenteer voor kinderen
- 4.1 IJzeren plaat in oplossing van koperzouten
- 4.2 Reiniging van zilveroxide
- 5 referenties
Mechanismen
Concepten en reacties
Voordat we ingaan op de mechanismen achter galvanische corrosie, moeten bepaalde concepten worden verduidelijkt.
Bij een redoxreactie verliest de ene soort elektronen (oxideert) terwijl een andere ze verkrijgt (vermindert). De elektrode waarop oxidatie plaatsvindt, wordt de anode genoemd; en waarop de reductie plaatsvindt, kathode (in het Engels de geheugenregel rode kat onthouden).
Dus voor een elektrode (een stuk, schroef, enz.) Van een metalen M, als deze oxideert, wordt gezegd dat het de anode is:
M => Mn+ + ne-
Het aantal vrijgekomen elektronen is gelijk aan de grootte van de positieve lading van het kation Mn+ resulterend.
Dan ontvangt een andere elektrode of metaal R (beide metalen moeten op de een of andere manier in contact zijn) de vrijgekomen elektronen; maar dit ondergaat geen chemische reactie als het elektronen krijgt, omdat het ze alleen zou geleiden (elektrische stroom).
Daarom moet er een andere soort in oplossing zijn die deze elektronen formeel kan accepteren; als gemakkelijk gereduceerde metaalionen, bijvoorbeeld:
Rn+ + ne- => R
Dat wil zeggen, er zou zich een metaallaag R vormen en de elektrode zou daarom zwaarder worden; terwijl het metaal M massa zou verliezen doordat zijn atomen oplossen.
Depolarisatoren
Wat als er geen metaalkationen waren die gemakkelijk genoeg konden worden gereduceerd? In dat geval nemen andere in het medium aanwezige soorten de elektronen op: de depolarisatoren. Deze hangen nauw samen met pH: Otwee, H.+, Oh- en HtweeOF.
Zuurstof en water krijgen elektronen in een reactie uitgedrukt door de volgende chemische vergelijking:
OFtwee + 2HtweeO + 4e- => 4OH-
Terwijl de H ionen+ transformeren in Htwee
2H+ + 2e- => Htwee
Dat wil zeggen, de soort OH- en Htwee zijn veel voorkomende producten van galvanische of elektrochemische corrosie.
Zelfs als het metaal R niet aan enige reactie deelneemt, bevordert het feit dat het edeler is dan M zijn oxidatie; en bijgevolg zal er een hogere productie van OH-ionen zijn- of waterstofgas. Omdat het tenslotte het verschil is tussen de reductiepotentialen, ΔE, een van de belangrijkste drijfveren van deze processen.
IJzercorrosie
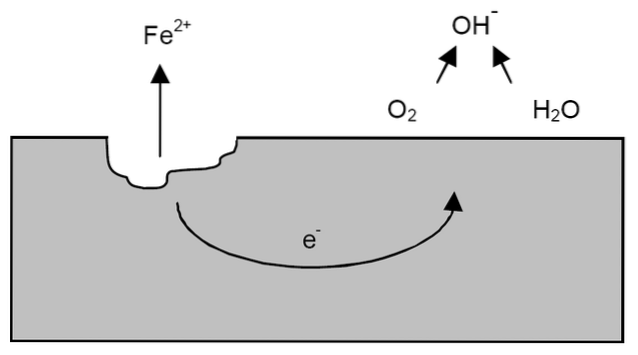
Na de voorgaande verduidelijkingen kan het voorbeeld van ijzercorrosie worden aangepakt (bovenste afbeelding). Stel dat er een dun laagje water is waarin zuurstof oplost. Zonder de aanwezigheid van andere metalen zullen de depolarisatoren de richtlijnen voor de reactie bepalen.
IJzer verliest dus enkele atomen van het oppervlak om in water op te lossen als Fe-kationen.twee+
Geloof => Gelooftwee+ + 2e-
De twee elektronen zullen door het stuk ijzer gaan omdat het een goede geleider van elektriciteit is. Dus waar de oxidatie of de anodeplaats begon, is bekend; maar niet waar de reductie zal plaatsvinden of de locatie van de kathodeplaats. De kathodeplaats kan overal zijn; en hoe groter het mogelijke oppervlak, hoe erger het metaal zal corroderen.
Stel dat de elektronen een punt bereiken zoals weergegeven in de afbeelding hierboven. Daar ondergaan zowel zuurstof als water de reeds beschreven reactie, waarbij OH vrijkomt-. Deze OH-anionen- kan reageren met de Fetwee+ om Fe (OH) te vormentwee, die neerslaat en daaropvolgende oxidaties ondergaat die het uiteindelijk in roest veranderen.
Ondertussen barst de anodeplaats steeds meer.
Voorbeelden
In het dagelijks leven zijn de voorbeelden van galvanische corrosie talrijk. We hoeven niet naar de ijzeren kroon te verwijzen: elk artefact gemaakt van metalen kan hetzelfde proces ondergaan in de aanwezigheid van vochtige en zoute omgevingen.
Naast het strand kan de winter ook ideale omstandigheden bieden voor corrosie; bijvoorbeeld bij het scheppen van zout in de sneeuw op de weg om te voorkomen dat auto's gaan slippen.
Fysiek gezien kan vocht worden vastgehouden in de gelaste verbindingen van twee metalen, die actieve corrosieplaatsen zijn. Dit komt omdat beide metalen zich gedragen als twee elektroden, en de meer reactieve zal zijn elektronen verliezen..
Als de productie van OH-ionen- Het is aanzienlijk, het kan zelfs de lak van de auto of het apparaat in kwestie aantasten.
Anodische indexen
Men kan zijn eigen voorbeelden van galvanische corrosie bouwen door gebruik te maken van de reductiepotentiaal tabellen. De anodische indextafel (op zichzelf vereenvoudigd) zal echter worden gekozen om dit punt te illustreren..
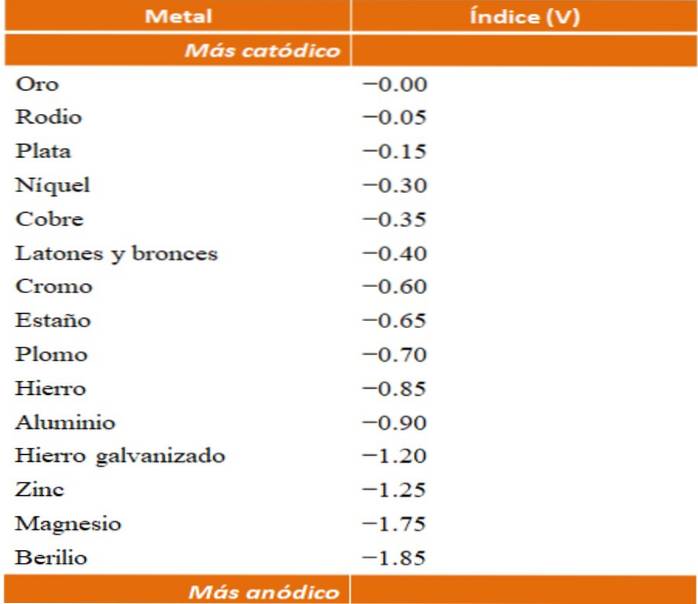
Stel dat we bijvoorbeeld een elektrochemische cel wilden bouwen. De metalen die bovenaan de anodische indextafel staan, zijn meer kathodisch; dat wil zeggen, ze worden gemakkelijk verkleind en het zal daarom moeilijk zijn om ze in oplossing te hebben. Terwijl de metalen aan de onderkant meer anodisch of reactief zijn en gemakkelijk corroderen.
Kiezen we voor goud en beryllium, dan zouden beide metalen niet lang samen kunnen zijn, aangezien beryllium extreem snel zou oxideren..
En als we daarentegen een oplossing van Ag-ionen hebben+ en we dompelen er een aluminium staafje in, dit zal oplossen op hetzelfde moment dat metallische zilverdeeltjes neerslaan. Als deze staaf was verbonden met een grafietelektrode, zouden elektronen ernaar reizen om er elektrochemisch zilver op af te zetten als een zilverfilm..
En als het in plaats van de aluminium staaf van koper zou zijn gemaakt, zou de oplossing blauwachtig worden door de aanwezigheid van Cu-ionen.twee+ in water.
Elektrochemische corrosiebescherming
Opofferingscoatings
Stel dat u een zinkplaat wilt beschermen tegen corrosie in aanwezigheid van andere metalen. De eenvoudigste optie zou zijn om magnesium toe te voegen, dat het zink zou bedekken, zodat, eenmaal geoxideerd, de elektronen die uit het magnesium vrijkomen, de Zn-kationen verminderen.twee+ terug.
De MgO-film op zink zou echter eerder dan later barsten, waardoor anodeplaatsen met hoge stroomdichtheid ontstaan; dat wil zeggen, de corrosie van het zink zou juist op die punten sterk versnellen.
Deze elektrochemische corrosiebeschermingstechniek staat bekend als het gebruik van opofferingscoatings. De bekendste is zink, gebruikt in de bekende techniek genaamd verzinken. Daarin is het metaal M, vooral ijzer, bedekt met zink (Fe / Zn).
Nogmaals, het zink oxideert en zijn oxide dient om het ijzer te bedekken en er elektronen naartoe te sturen die het Fe verminderentwee+ dat kan worden gevormd.
Edele coatings
Stel nogmaals dat u dezelfde plaat zink wilt beschermen, maar nu gaat u chroom gebruiken in plaats van magnesium. Chroom is edeler (meer kathodisch, zie tabel met anodische indexen) dan zink en werkt daarom als een edele coating.
Het probleem met dit type coating is dat als het eenmaal barst, het de oxidatie van het metaal eronder verder zal bevorderen en versnellen; in dit geval zou het zink zelfs meer corroderen dan wanneer het wordt bekleed met magnesium.
En tot slot zijn er nog andere coatings die bestaan uit verf, plastic, antioxidanten, vetten, harsen, etc..
Experimenteer voor kinderen
IJzeren plaat in oplossing van koperzouten
Een eenvoudig experiment kan worden bedacht uit dezelfde tabel met anode-indices. Een redelijke hoeveelheid (minder dan 10 gram) CuSO oplossen45HtweeOf in water, een kind wordt gevraagd om in een gepolijste ijzeren plaat te dopen. Er wordt een foto gemaakt en het proces mag zich een paar weken voltrekken.
De oplossing is aanvankelijk blauwachtig, maar zal beginnen te vervagen terwijl de ijzeren plaat een koperachtige kleur krijgt. Dit komt omdat koper edeler is dan ijzer, en daarom zijn de kationen Cutwee+ Ze worden gereduceerd tot metallisch koper uit de ionen die worden verkregen door de oxidatie van ijzer:
Geloof => Gelooftwee+ + 2e-
Cutwee+ + 2e- => Cu
Zilveroxide reiniging
Zilveren voorwerpen worden na verloop van tijd zwart, vooral als ze in contact komen met een bron van zwavelverbindingen. De roest kan worden verwijderd door het object onder te dompelen in een bak met water met zuiveringszout en aluminiumfolie. Het bicarbonaat zorgt voor de elektrolyten die het transport van elektronen tussen het object en het aluminium vergemakkelijken.
Als gevolg hiervan zal het kind begrijpen dat het object zijn zwarte vlekken verliest en zal gloeien met zijn karakteristieke zilveren kleur; terwijl de aluminiumfolie zal corroderen om te verdwijnen.
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8e ed.). CENGAGE Leren.
- Wikipedia. (2019). Galvanische corrosie. Hersteld van: en.wikipedia.org
- Stephen Lower. (16 juni 2019). Elektrochemische corrosie. Chemie LibreTexts. Hersteld van: chem.libretexts.org
- De Open Universiteit. (2018). 2.4 Corrosieprocessen: galvanische corrosie. Hersteld van: open.edu
- Technische klantenservice Brush Wellman Inc. (s.f.). Een gids voor galvanische corrosie. Borstel Wellman Engineered Materials.
- Giorgio Carboni. (1998). Experimenten in elektrochemie. Hersteld van: funsci.com



Niemand heeft nog op dit artikel gereageerd.