
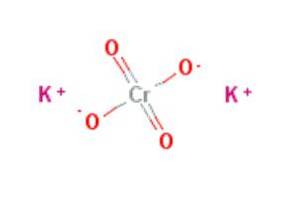
Kaliumchromaat (K2CrO4) Eigenschappen, risico's en toepassingen
De kaliumchromaat is een anorganische verbinding met formule KtweeCrO4, gekenmerkt doordat het een krachtig oxidatiemiddel is. Het wordt bereid door kaliumdichromaat te behandelen met kaliumhydroxide volgens de reactie: KtweeCrO7 + 2KOH → 2KtweeCrO4 + H.tweeOF.
Als verbinding met een relatief uniek profiel heeft kaliumchromaat een aantal toepassingen in industriële en wetenschappelijke contexten. Vanwege de toxiciteit moet de blootstelling echter worden beperkt (JACOBS, 2015).
Artikel index
- 1 Fysische en chemische eigenschappen
- 2 Reactiviteit en gevaren
- 3 toepassingen
- 4 referenties
Fysische en chemische eigenschappen
Kaliumchromaat zijn orthorombische kristallen met een gelige kleur die een karakteristiek aroma missen en een onaangename bittere smaak hebben (National Center for Biotechnology Information, 2017).

Het molecuulgewicht is 194,19 g / mol en de dichtheid is 2,7320 g / ml. Het heeft een smeltpunt van 968 ° C en een kookpunt van 1000 ° C.
De verbinding is onoplosbaar in alcohol en zeer oplosbaar in water, en kan 62,9 gram per 100 ml oplosmiddel oplossen bij 20 ° C (Royal Society of Chemistry, 2015).
Reactiviteit en gevaren
Oxidatiemiddelen, zoals kaliumchromaat, kunnen reageren met reductiemiddelen om warmte en producten te genereren die gasvormig kunnen zijn (waardoor gesloten containers onder druk komen te staan).
Producten kunnen mogelijk tot aanvullende reacties leiden (zoals verbranding in lucht). Chemische reductie van materialen in deze groep kan snel of zelfs explosief zijn, maar vereist vaak initiatie (hitte, vonk, katalysator, toevoeging van een oplosmiddel).
Explosieve mengsels van anorganische oxidatiemiddelen met reductiemiddelen blijven vaak gedurende lange perioden onveranderd als initiatie wordt vermeden. Dergelijke systemen zijn typisch mengsels van vaste stoffen, maar kunnen elke combinatie van fysische toestanden omvatten. Sommige anorganische oxidatiemiddelen zijn metaalzouten die oplosbaar zijn in water..
Het oplossen neemt af, maar heft het oxiderende vermogen van dergelijke materialen niet op. Organische verbindingen hebben over het algemeen enig reducerend vermogen en kunnen in principe reageren met verbindingen van deze klasse.
De werkelijke reactiviteit varieert sterk met de identiteit van de organische verbinding. Anorganische oxidatiemiddelen kunnen heftig reageren met actieve metalen, cyaniden, esters en thiocyanaten.
De compound vormt een bedreiging voor het milieu. Er moeten onmiddellijk maatregelen worden genomen om de verspreiding ervan te beperken. Wanneer kaliumchromaat overal en voor welk doel dan ook wordt gebruikt, moet het effectief worden ingesloten en verwijderd om wegvloeien of lekken in het milieu te voorkomen..
Bovendien heeft kaliumchromaat het vermogen om de intensiteit van een brand te verhogen als de chemische stof in contact komt met brandbare materialen. De verbinding geeft bij verhitting giftige chroomdampen af (POTASSIUM CHROMATE, 2016).
Kaliumchromaat is zeer corrosief en is een sterk oxidatiemiddel. Het tast voornamelijk de neus, keel en longen aan en veroorzaakt zweren, kortademigheid, bronchitis, longontsteking en astma, maar het kan ook het maagdarmkanaal, de lever, de nieren en het immuunsysteem aantasten..
Deze stof is een bekend carcinogeen voor de mens en wordt in verband gebracht met een verhoogd risico op het ontwikkelen van longkanker en kanker van de sinonasale holte (Kaliumchromaat, 2016).
De geurloze aard ervan wordt problematisch wanneer het is blootgesteld aan deze chemische stof vanwege zijn toxiciteit. In veel gevallen weet u misschien niet dat u kaliumchromaat heeft ingeademd..
Bovendien brengt het inademen van deze chemische stof verschillende risico's met zich mee. Symptomen zijn onder meer misselijkheid, braken, buikpijn, branderig gevoel, diarree, shock of flauwvallen..
In geval van contact met de ogen, moeten de contactlenzen worden gecontroleerd en verwijderd. Daarna is het noodzakelijk om de ogen onmiddellijk met veel water te spoelen gedurende minimaal 15 minuten met koud water.
In geval van contact met de huid, moet het getroffen gebied onmiddellijk worden gespoeld met veel water gedurende minstens 15 minuten, terwijl de besmette kleding en schoenen worden verwijderd. Bedek geïrriteerde huid met een verzachtend middel.
Was kleding en schoenen voordat u ze opnieuw gebruikt. Als het contact ernstig is, was dan met een desinfecterende zeep en bedek de besmette huid met een antibacteriële crème.
Bij inademing moet het slachtoffer naar een koele plaats worden verplaatst. Als de patiënt niet ademt, wordt kunstmatige beademing gegeven.
Als de verbinding wordt ingeslikt, mag braken niet worden opgewekt, tenzij voorgeschreven door medisch personeel. Maak strak zittende kleding los, zoals een overhemdkraag, riem of stropdas.
In alle gevallen moet onmiddellijk medische hulp worden ingeroepen (Veiligheidsinformatieblad Kaliumchromaat, 2013).
Toepassingen
Kaliumchromaat kent een grote verscheidenheid aan industriële toepassingen. In de textielindustrie gebruiken fabrikanten kaliumchromaat om leer te looien en kleding en stoffen te verven (Dye, 2017).
Het werkt ook als oxidatiemiddel in de industrie en bij organische synthese. Het wordt medisch gebruikt als een extern antisepticum of samentrekkend middel en is aanwezig in sommige diergeneesmiddelen.
Kaliumchromaat wordt gebruikt als indicator bij de bepaling van chloride door titratie met standaard zilvernitraatoplossing. Deze methode wordt de chloridebepalingsmethode van Mohr genoemd..
Deze methode berust op de vorming van een rood zilverchromaatprecipitaat aan het eindpunt, nadat al het chloride is neergeslagen als wit zilverchloride..
Gewoonlijk wordt een 5% -oplossing van kaliumchromaat gebruikt die met chloride is geneutraliseerd. Ongeveer 1 ml van deze indicator moet worden gebruikt per 100 ml monstervolume (RICCA Chemical Company, 2015). De reacties voor de Mohr-titratie zijn:
Ag+ + Cl- → AgCl (wit neerslag)
2 Ag+ (overmaat) + CrO4twee- → AgtweeCrO4 (rode neerslag aan het eindpunt)
Referenties
- Dye, J. L. (2017, 1 maart). Kalium (K) CHEMISCH ELEMENT. Opgehaald van encyclopedie britannica.com.
- JACOBS, J. (2015, 3 augustus). Waar wordt kaliumchromaat voor gebruikt? Opgehaald van livestrong.com.
- Veiligheidsinformatieblad Kaliumchromaat. (2013, 21 mei). Opgehaald van sciencelab.com.
- Nationaal centrum voor informatie over biotechnologie. (2017, 4 maart). PubChem samengestelde database; CID = 24597. Opgehaald van PubChem.
- Kaliumchromaat. (2016, 27 februari). Opgehaald van NCIt.
- KALIUMCHROMAAT. (2016). Hersteld van cameochemicaliën.
- RICCA Chemical Company. (2015). kaliumchromaat. Hersteld van riccachemical.
- Royal Society of Chemistry. (2015). Kaliumchromaat. Opgehaald van chemspider.com.


Niemand heeft nog op dit artikel gereageerd.