
Stooklijn wat is het, hoe wordt het gedaan, voorbeelden
EEN stooklijn is de grafische weergave van hoe de temperatuur van een monster varieert als een functie van de tijd, waarbij de druk constant wordt gehouden en de warmte gelijkmatig wordt toegevoegd, dat wil zeggen met een constante snelheid.
Om een grafiek van dit type te maken, worden paren van temperatuur- en tijdwaarden genomen, die later in een grafiek worden weergegeven door de temperatuur op de verticale as (ordinaat) en de tijd op de horizontale as (abscis) te plaatsen..

Vervolgens wordt de meest geschikte curve op deze experimentele punten gepast en wordt tenslotte een grafiek van de temperatuur T verkregen als functie van de tijd t: T (t).
Artikel index
- 1 Wat is de verwarmingscurve?
- 1.1 - Verandering van toestand in een stof
- 2 Hoe maak je een stooklijn?
- 3 voorbeelden (water, ijzer ...)
- 3.1 Smelten van het ijs
- 3.2 Water omzetten in stoom
- 4 referenties
Wat is de verwarmingscurve?
Terwijl het wordt verwarmd, doorloopt een stof achtereenvolgens verschillende toestanden: van een vaste stof kan het een damp worden, bijna altijd door de vloeibare toestand. Deze processen worden toestandsveranderingen genoemd, waarbij het monster zijn interne energie verhoogt terwijl er warmte wordt toegevoegd, zoals aangegeven door de moleculaire kinetische theorie..
Bij het toevoegen van warmte aan een monster zijn er twee mogelijkheden:
- De stof verhoogt zijn temperatuur, omdat zijn deeltjes met grotere intensiteit worden geagiteerd.
- Het materiaal ondergaat een faseverandering, waarbij de temperatuur constant blijft. Door warmte toe te voegen verzwakken de krachten die de deeltjes bij elkaar houden tot op zekere hoogte, waardoor het gemakkelijk is om van bijvoorbeeld ijs naar vloeibaar water te gaan..
Figuur 2 toont de vier toestanden van materie: vast, vloeibaar, gas en plasma, en de namen van de processen die de overgang tussen beide mogelijk maken. Pijlen geven de richting van het proces aan.
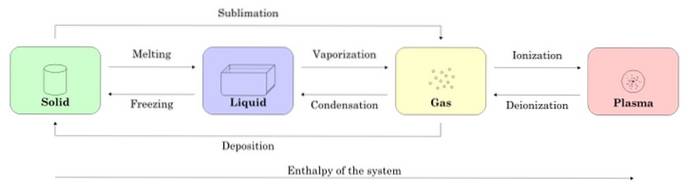
-Veranderingen van toestand in een stof
Beginnend met een monster in vaste toestand, wanneer het smelt, gaat het naar de vloeibare toestand, wanneer het verdampt, verandert het in gas en door ionisatie verandert het in plasma.
De vaste stof kan direct in gas worden omgezet door het proces dat bekend staat als sublimatie. Er zijn stoffen die gemakkelijk sublimeren bij kamertemperatuur. De bekendste is de COtwee of droogijs, evenals naftaleen en jodium.
Terwijl het monster een toestandverandering ondergaat, blijft de temperatuur constant totdat de nieuwe toestand wordt bereikt. Dit betekent dat als u bijvoorbeeld een portie vloeibaar water heeft dat zijn kookpunt heeft bereikt, de temperatuur constant blijft totdat al het water in stoom is veranderd..
Om deze reden wordt verwacht dat de opwarmcurve bestaat uit een combinatie van toenemende secties en horizontale secties, waarbij deze laatste overeenkomen met faseveranderingen. Figuur 3 toont een van deze curven voor een bepaalde stof.
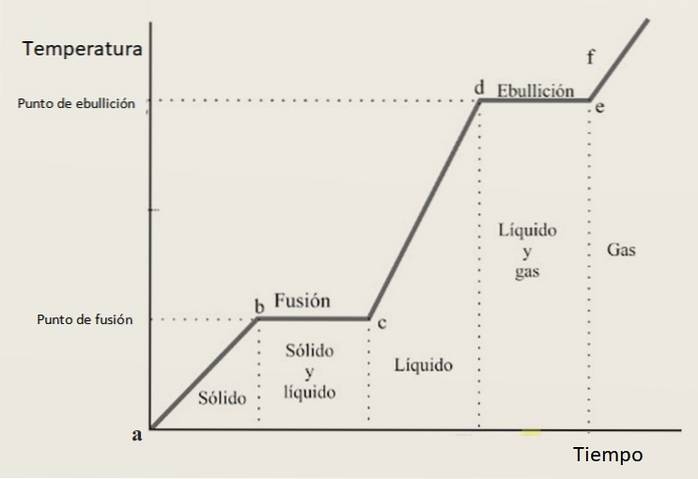
Interpretatie van de verwarmingscurve
In de groei-intervallen ab, CD Y ef de stof wordt respectievelijk als vaste stof, vloeistof en gas aangetroffen. In deze gebieden stijgt de kinetische energie en daarmee de temperatuur.
ondertussen in bc het verandert zijn toestand van vast naar vloeibaar, daarom bestaan de twee fasen naast elkaar. Dit is hoe het gebeurt in de sectie van, waarin het monster verandert van vloeistof naar gas. Hier verandert de potentiële energie en blijft de temperatuur constant.
De omgekeerde procedure is ook mogelijk, dat wil zeggen dat het monster kan worden gekoeld om achtereenvolgens andere toestanden aan te nemen. In zo'n geval spreken we van koelcurve.
De stookcurves hebben voor alle stoffen hetzelfde algemene uiterlijk, maar natuurlijk niet dezelfde numerieke waarden. Sommige stoffen hebben meer tijd nodig dan andere om van toestand te veranderen, en ze smelten en verdampen bij verschillende temperaturen..
Deze punten staan bekend als respectievelijk smeltpunt en kookpunt, en zijn kenmerken van elke stof..
Dat is de reden waarom de verwarmingskrommen erg nuttig zijn, omdat ze de numerieke waarde van deze temperaturen aangeven voor miljoenen stoffen die bestaan als vaste stoffen en vloeistoffen in het bereik van temperaturen die als normaal worden beschouwd en bij atmosferische druk..
Hoe doe je een opwarmcurve?
In principe is het heel eenvoudig: doe gewoon een monster van de stof in een bakje met roerder, steek er een thermometer in en verwarm gelijkmatig..
Tegelijkertijd wordt bij het starten van de procedure een stopwatch geactiveerd en worden de overeenkomstige temperatuur-tijdparen van tijd tot tijd genoteerd..
De warmtebron kan een gasbrander zijn, met een goede verwarmingssnelheid, of een elektrische weerstand die warmte afgeeft bij verhitting, die kan worden aangesloten op een variabele bron om verschillende vermogens te verkrijgen..
Voor meer precisie zijn er twee technieken die veel worden gebruikt in het chemielaboratorium:
- Differentiële thermische analyse.
- Differentiële scanningcalorimetrie.
Ze vergelijken het temperatuurverschil tussen het onderzochte monster en een ander referentiemonster met een hoge smelttemperatuur, bijna altijd een aluminiumoxide. Met deze methoden is het gemakkelijk om het smelt- en kookpunt te vinden.
Voorbeelden (water, ijzer ...)
Beschouw de stooklijnen voor water en ijzer in de afbeelding. De tijdschaal wordt niet weergegeven, maar het is onmiddellijk om de smelttemperaturen voor beide stoffen te onderscheiden die overeenkomen met punt B van elke grafiek: voor water 0 º C, voor ijzer 1500 º C.
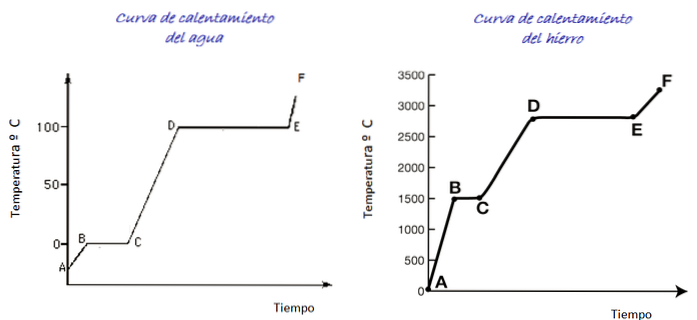
Water is een universele stof en het temperatuurbereik dat nodig is om de toestandsveranderingen te zien, is gemakkelijk te bereiken in het laboratorium. Voor ijzer zijn veel hogere temperaturen nodig, maar zoals hierboven opgemerkt, verandert de vorm van de grafiek niet wezenlijk..
Het ijs smelten
Bij het verwarmen van het ijsmonster bevinden we ons volgens de grafiek op punt A, bij een temperatuur onder 0 ° C. Er wordt opgemerkt dat de temperatuur met een constante snelheid toeneemt tot 0 ° C.
De watermoleculen in het ijs trillen met een grotere amplitude. Zodra de smelttemperatuur (punt B) is bereikt, kunnen de moleculen al voor elkaar bewegen.
De energie die binnenkomt, wordt geïnvesteerd in het verminderen van de aantrekkingskracht tussen de moleculen, zodat de temperatuur tussen B en C constant blijft totdat al het ijs is gesmolten..
Water in stoom veranderen
Als het water eenmaal volledig vloeibaar is, neemt de trilling van de moleculen weer toe en stijgt de temperatuur snel tussen C en D tot het kookpunt van 100º C. Tussen D en E blijft de temperatuur op die waarde terwijl de energie die binnenkomt zorgt ervoor dat al het water in de container verdampt.
Als alle waterdamp in een container kan worden bewaard, kan deze doorgaan met verwarmen van punt E naar punt F, waarvan de limiet niet in de grafiek wordt weergegeven..
Een ijzermonster kan dezelfde veranderingen ondergaan. Gezien de aard van het materiaal zijn de temperatuurbereiken echter heel verschillend..
Referenties
- Atkins, P. Principles of Chemistry: The Paths of Discovery. Redactioneel Médica Panamericana. 219-221.
- Chung, P. Verwarmingscurves. Hersteld van: chem.libretexts.org.
- Verwarmingscurves. Warmte van fusie en verdamping. Hersteld van: wikipremed.com.
- Hewitt, Paul. 2012. Conceptuele fysische wetenschappen. 5e. Ed Pearson. 174-180.
- Universiteit van Valladolid. Diploma in scheikunde, hersteld van: Lodging.uva.es.



Niemand heeft nog op dit artikel gereageerd.