
Eenvoudig distillatieproces en voorbeelden
De eenvoudige distillatie is een procedure waarbij de dampen geproduceerd uit een vloeistof rechtstreeks naar een condensor worden gebracht, waarbinnen de temperatuur van de dampen daalt en hun condensatie optreedt.
Het wordt gebruikt om een vluchtige component te scheiden van de niet-vluchtige componenten die in een vloeistof aanwezig zijn. Het wordt ook gebruikt voor het scheiden van twee vloeistoffen die aanwezig zijn in een oplossing met zeer verschillende kookpunten..
Eenvoudige destillatie is geen efficiënte methode voor het scheiden van twee vluchtige vloeistoffen die in een oplossing aanwezig zijn. Wanneer de temperatuur ervan stijgt door de toevoer van warmte, neemt ook de kinetische energie van de moleculen toe, waardoor ze de cohesiekracht tussen hen kunnen overwinnen..
Vluchtige vloeistoffen beginnen te koken wanneer hun dampdruk gelijk is aan de externe druk die op het oppervlak van de oplossing wordt uitgeoefend. Beide vloeistoffen dragen bij aan de samenstelling van de gevormde damp, waarbij de meer vluchtige vloeistof groter is; dat wil zeggen degene met het laagste kookpunt.
Daarom vormt de meer vluchtige vloeistof het grootste deel van het gevormde destillaat. Het proces wordt herhaald totdat een gewenste zuiverheid of de hoogst mogelijke concentratie is bereikt..
Artikel index
- 1 Eenvoudig distillatieproces
- 1.1 Apparatuur
- 1.2 Condensator
- 1.3 Verwarming
- 2 voorbeelden
- 2.1 Destillatie van water en alcohol
- 2.2 Vloeistof-vaste stof scheiding
- 2.3 Alcohol en glycerine
- 3 referenties
Eenvoudig distillatieproces
Bij eenvoudige destillatie wordt de temperatuur van een oplossing verhoogd totdat deze kookt. Op dat moment vindt de overgang van vloeibare naar gasvormige toestanden plaats. Dit wordt waargenomen wanneer een constant borrelen begint in de oplossing.
Team
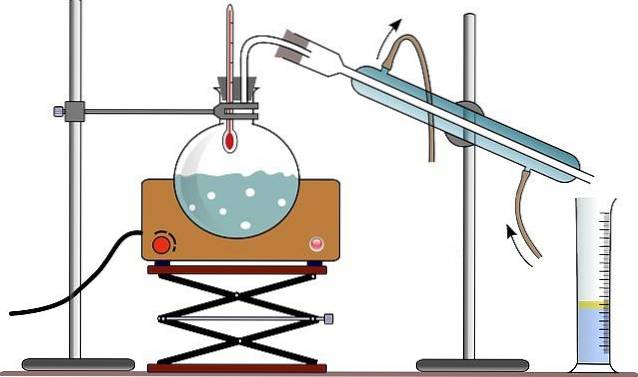
De apparatuur voor eenvoudige destillatie bestaat meestal uit een brander of een verwarmingsdeken (zie afbeelding); een ronde vuurvaste glazen kolf met een ingeslepen glazen mond, om de koppeling mogelijk te maken; en enkele glazen kralen (sommige gebruiken een houten stok) om de grootte van de gevormde bellen te verkleinen.
De glasparels dienen als bellenvormende kernen, die de vloeistof langzaam laten koken, waardoor oververhitting wordt vermeden, wat resulteert in de vorming van een soort gigantische bellen; zelfs in staat om een massa vloeistof uit de destillatiekolf te verdrijven.
Aan de monding van de kolf zit een vuurvaste glazen adapter met drie monden, die zijn gemaakt van geslepen glas. Een hals is bevestigd aan de destillatiekolf, een tweede hals is bevestigd aan de condensor en de derde hals is gesloten met een rubberen stop..
In de afbeelding mist de houder deze adapter; en in plaats daarvan worden door dezelfde rubberen stop de thermometer en een directe connector naar de condensor geplaatst.
Condensor
De condensor is een apparaat dat is ontworpen om de functie te vervullen die de naam aangeeft: om de stoom die er doorheen beweegt te condenseren. Via zijn bovenmond is het gekoppeld aan de adapter, en via zijn ondermond is het verbonden met een ballon waar de destillatieproducten worden verzameld..
In het geval van de afbeelding gebruiken ze (hoewel dit niet altijd correct is) een maatcilinder om het gedestilleerde volume in één keer te meten.
Het water dat door de buitenmantel van de condensor circuleert, komt het binnen via het onderste deel en verlaat het via het bovenste deel. Dit zorgt ervoor dat de condensortemperatuur laag genoeg is om condensatie van de in de destillatiekolf geproduceerde dampen mogelijk te maken..
Alle onderdelen van het destillatieapparaat zijn bevestigd met klemmen die zijn verbonden met een metalen steun.
Een volume van de te destilleren oplossing wordt in een ronde kolf met een geschikte inhoud gebracht.
De juiste verbindingen worden gemaakt met grafiet of vet om een efficiënte afdichting te garanderen, en het verwarmen van de oplossing begint. Tegelijkertijd begint de doorgang van water door de condensor.
Verwarming
Terwijl de destillatiekolf wordt verwarmd, wordt een temperatuurstijging waargenomen op de thermometer, totdat een punt wordt bereikt waarop de temperatuur constant blijft. Dit blijft zo, zelfs als de verwarming doorgaat; tenzij alle vluchtige vloeistof volledig is verdampt.
De verklaring voor dit gedrag is dat het kookpunt van de component met het laagste kookpunt van het vloeibare mengsel is bereikt, waarbij de dampspanning gelijk is aan de externe druk (760 mm Hg).
Op dit punt wordt alle warmte-energie verbruikt bij de overgang van de vloeibare toestand naar de gasvormige toestand waarbij de intermoleculaire cohesiekracht van de vloeistof afloopt. Daarom vertaalt de toevoer van warmte zich niet in een temperatuurstijging..
Het vloeibare product van de destillatie wordt opgevangen in correct geëtiketteerde kolven, waarvan het volume afhangt van het volume dat oorspronkelijk in de destillatiekolf is geplaatst..
Voorbeelden
Destillatie van water en alcohol
Je hebt een oplossing van 50% alcohol in water. Wetende dat het kookpunt van alcohol 78,4 ° C is en het kookpunt van water ongeveer 100 ° C, kan dan een zuivere alcohol worden verkregen met een eenvoudige destillatiestap? Het antwoord is nee.
Door het alcohol-watermengsel te verwarmen wordt aanvankelijk het kookpunt van de meest vluchtige vloeistof bereikt; in dit geval alcohol. De gevormde stoom zal een hoger aandeel van de alcohol bevatten, maar er zal ook veel water in de stoom aanwezig zijn, aangezien de kookpunten vergelijkbaar zijn..
De vloeistof die wordt verzameld bij de destillatie en condensatie, heeft een alcoholpercentage van meer dan 50%. Als deze vloeistof aan opeenvolgende destillaties wordt onderworpen, kan een geconcentreerde alcoholoplossing worden verkregen; maar niet puur, omdat de dampen water naar een bepaalde samenstelling blijven slepen en een zogenaamde azeotroop vormen
Het vloeibare product van de fermentatie van suikers heeft een alcoholpercentage van 10%. Deze concentratie die, zoals in het geval van Whisky, op 50% kan worden gebracht door eenvoudige destillatie.
Vloeistof-vaste stof scheiding
Een oplossing van een zout in water bestaat uit een vloeistof die kan vervluchtigen, en een niet-vluchtige verbinding met een hoog kookpunt: zout..
Door de oplossing te destilleren kan zuiver water worden verkregen in de condensatievloeistof. Ondertussen zullen de zouten op de bodem van de destillatiekolf bezinken.
Alcohol en glycerine
Er is een mengsel van ethylalcohol met een kookpunt van 78,4 ° C en glycerine met een kookpunt van 260 ° C. Bij eenvoudige destillatie zal de gevormde damp een zeer hoog alcoholpercentage hebben, bijna 100%..
Daarom wordt een gedestilleerde vloeistof verkregen met een percentage alcohol, vergelijkbaar met dat van stoom. Dit komt doordat de kookpunten van vloeistoffen heel verschillend zijn.
Referenties
- Claude Yoder. (2019). Distillatie. Bekabelde chemie. Hersteld van: wiredchemist.com
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8e ed.). CENGAGE Leren.
- Dragani, Rachelle. (17 mei 2018). Drie voorbeelden van eenvoudige destillatiemengsels. Wetenschappelijk. Hersteld van: sciencing.com
- Helmenstine, Anne Marie, Ph.D. (02 januari 2019). Wat is destillatie? Chemistry Definition. Hersteld van: thoughtco.com
- Dr Welder. (s.f.). Eenvoudige destillatie. Hersteld van: dartmouth.edu
- Universiteit van Barcelona. (s.f.). Distillatie. Hersteld van: ub.edu



Niemand heeft nog op dit artikel gereageerd.