
Eigenschappen van dibenzalaceton, reactiemechanisme, gebruik, risico's
De dibenzalaceton (dba) is een organische verbinding waarvan de molecuulformule C is17H.14O. Het is een gelige vaste stof die, afhankelijk van de zuiverheid, als kristallen kan verschijnen. Het wordt gebruikt in zonnebrandmiddelen en organometaalsyntheses waarin palladium als katalysator wordt gebruikt.
Hoewel de synthese ervan een relatief eenvoudig proces is, dat nogal regelmatig voorkomt in leerlaboratoria om aldolcondensatie te verklaren, is het mechanisme enigszins uitgebreid en moet met verschillende factoren rekening worden gehouden. Het benzaldehyde dat wordt gebruikt, dat zal condenseren met aceton, moet vers worden gedestilleerd om zijn lage oxidatie in contact met lucht te garanderen..

Evenzo wordt een basisch ethanol-watermedium gebruikt om de reagentia op te lossen en tegelijkertijd de uiteindelijke precipitatie van dibenzalaceton, een hydrofobe en onoplosbare verbinding, te bevorderen. Tot dusver is het niet bekend welke negatieve effecten dibenzalaceton kan hebben op het lichaam of het milieu, behalve dat het een irriterende stof is..
Artikel index
- 1 Eigenschappen
- 1.1 Fysiek uiterlijk
- 1,2 molaire massa
- 1.3 Isomeren
- 1.4 Smeltpunt
- 1.5 Oplosbaarheid in water
- 1.6 Structuur
- 2 Reactiemechanisme van dibenzalaceton
- 3 Synthese
- 3.1 Reagentia
- 3.2 Werkwijze
- 3.3 Herkristallisatie
- 4 toepassingen
- 5 Risico's
- 6 referenties
Eigendommen
Fysiek uiterlijk
Stoffige of kristallijn uitziende gelige vaste stof.
Molaire massa
234,29 g / mol
Isomeren
Dibenzalaceton komt voor als drie geometrische isomeren: trans-trans, trans-cis en cis-cis. Het trans-trans-isomeer is het meest stabiele van allemaal en wordt daarom het meest geproduceerd tijdens de synthese.
Smeltpunt
110-111 ° C. Dit bereik varieert afhankelijk van de zuiverheidsgraad van de gesynthetiseerde vaste stof..
Oplosbaarheid in water
Onoplosbaar.
Structuur
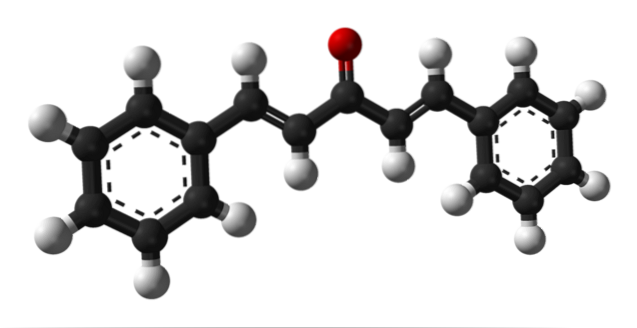
De bovenste afbeelding toont het molecuul van het trans-trans-dibenzalaceton-isomeer, weergegeven door een model van bollen en staven. In het midden ervan hebben we de carbonylgroep en aan de zijkanten enkele dubbele bindingen en twee aromatische benzeenringen.
Dibenzalaceton is in wezen apolair en hydrofoob, aangezien de gehele structuur praktisch is samengesteld uit koolstof- en waterstofatomen. De carbonylgroep geeft het slechts een klein dipoolmoment.
De structuur kan worden vergeleken met die van een blad, aangezien al zijn koolstofatomen sp-hybridisatie hebbentweedaarom rusten ze op hetzelfde vlak.
Fotonen van licht werken samen met het π-geconjugeerde systeem van dibenzalaceton; vooral die van UV-straling, die wordt geabsorbeerd om gedelokaliseerde elektronen te exciteren. Deze eigenschap maakt dibenzalaceton een uitstekende absorber van ultraviolet licht..
Reactiemechanisme van dibenzalaceton
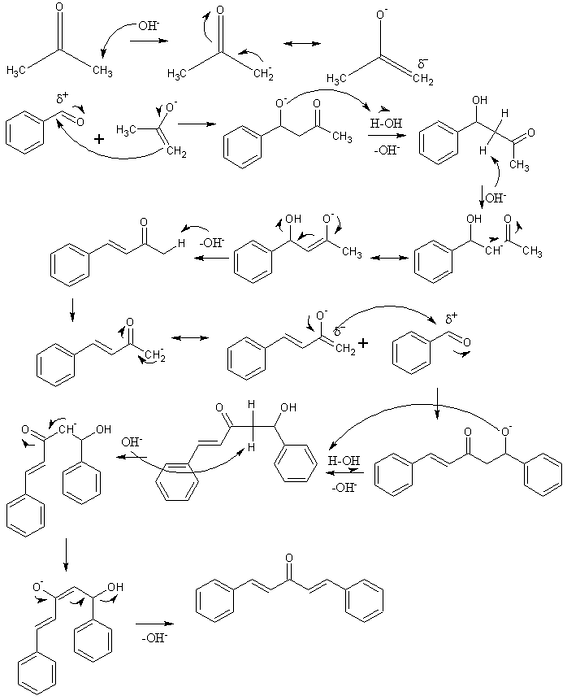
In de bovenste afbeelding hebben we het mechanisme van de aldolcondensatie tussen benzaldehyde en aceton weergegeven, waardoor dibenzalaceton ontstaat; specifiek zijn trans-trans-isomeer.
De reactie begint met aceton in een basisch medium. De OH- deprotoneert een zuur proton van een van zijn twee methylgroepen, -CH3, waardoor een enolaat ontstaat: CH3C (O) CHtwee-, die zijn negatieve lading delokaliseert door resonantie (eerste rij van het beeld).
Dit enolaat werkt dan als een nucleofiel agens: het valt de carbonylgroep van een benzaldehydemolecuul aan. De opname ervan in benzaldehyde genereert een alkoxide, dat, omdat het erg basisch is, een watermolecuul deprotoneert en een aldol wordt (tweede rij). Het aldol of β-hydroxyketon wordt gekenmerkt door de groepen C = O en OH.
Het basismedium dehydrateert dit aldol en er ontstaat een dubbele binding in zijn structuur, die benzylideenaceton genereert (derde rij). Vervolgens de OH- het deprotoneert ook een van zijn zure waterstofatomen en herhaalt nog een nucleofiele aanval op een tweede benzaldehydemolecuul. Deze keer vindt de aanval plaats met een lagere snelheid (vierde rij).
Het gevormde product deprotoneert een ander watermolecuul en ondergaat opnieuw dehydratie om de OH-groep te elimineren en een tweede dubbele binding tot stand te brengen (vijfde en zesde rij). Zo en tenslotte wordt dibenzalaceton geproduceerd.
Synthese
Reagentia
De reagentia voor het uitvoeren van de synthese van dibenzalaceton zijn de volgende:
- 95% ethanol.
- Vers gedestilleerd benzaldehyde uit bittere amandelolie.
- NaOH als basische katalysator in gedestilleerd water.
De te gebruiken hoeveelheden zijn afhankelijk van hoeveel dibenzalaceton moet worden gesynthetiseerd. Er wordt echter naar gestreefd dat er een overmaat aan benzaldehyde is, omdat een deel daarvan wordt geoxideerd tot benzoëzuur. Ook wordt gegarandeerd dat de reactie minder tijd kost en dat het ongewenste benzylideenaceton in mindere mate wordt geproduceerd..
Ethanol werkt als een oplosmiddel voor benzaldehyde, anders lost het niet op in het basische NaOH-medium.
Werkwijze
Meng de ethanol met de benzaldehyde in een grote beker. Vervolgens wordt het basische NaOH-medium toegevoegd tijdens constant magnetisch roeren. In deze stap treedt de Cannizzaro-reactie in mindere mate op; dat wil zeggen, twee moleculen benzaldehyde die niet in verhouding staan tot een van benzylalcohol en de andere van benzoëzuur, gemakkelijk herkenbaar aan zijn karakteristieke zoete geur.
Ten slotte wordt de aceton toegevoegd en wordt de oplossing een half uur gewacht om troebel en geeloranje van kleur te worden. Dibenzalaceton zal neerslaan als gevolg van water, dus een aanzienlijke hoeveelheid water wordt toegevoegd om de volledige neerslag te bevorderen..
Het dibenzalaceton wordt onder vacuüm gefiltreerd en de gelige vaste stof wordt verschillende keren met gedestilleerd water gewassen..
Herkristallisatie

Om het dibenzalaceton te zuiveren, wordt 95% ethanol of hete ethylacetaat gebruikt, zodat bij elke herhaling van de herkristallisatie kristallen met een grotere zuiverheid worden verkregen. Het aanvankelijke geelachtige poeder zal dus worden omgezet in kleine gele kristallen van dibenzalaceton..
Toepassingen
Dibenzalaceton is een verbinding die niet veel toepassingen heeft. Vanwege zijn vermogen om ultraviolet licht te absorberen, wordt het gebruikt bij de formulering van zonnebrandmiddelen of elk ander product dat de incidentie van UV-stralen probeert te verminderen, of het nu gaat om coatings of verven..
Aan de andere kant wordt dibenzalaceton gebruikt in de organometaalsyntheses van palladium. Het fungeert als een bindmiddel dat coördineert met de palladiummetaalatomen, Pd0, om het tris (dibenzylideenaceton) dipalladiumcomplex te vormen (0).
Deze organometaalverbinding levert Pd-atomen0 in verschillende organische syntheses, dus het gedraagt zich als een homogene katalysator, omdat het oplost in veel organische oplosmiddelen.
Ook is dibenzalaceton als bindmiddel gemakkelijk te vervangen door andere organische bindmiddelen, waardoor de organometaalsyntheses van palladium zich snel kunnen ontwikkelen..
Risico's
Met betrekking tot de risico's is er niet veel informatie beschikbaar die rapporteert over de mogelijke gevolgen voor de gezondheid of het milieu die dibenzalaceton kan veroorzaken. In zuivere staat is het een vaste stof irriterend bij inslikken, ademen of door direct contact met de ogen of de huid..
Het is echter blijkbaar niet irriterend genoeg dat het geen deel kan uitmaken van formuleringen voor zonnebrandcrème. Aan de andere kant, omdat het zo onoplosbaar is in water, is de concentratie ervan verwaarloosbaar en presenteert het zichzelf als een vaste verontreiniging. In die zin is het niet bekend hoe schadelijk de troebelheid die het veroorzaakt, is voor de mariene fauna of bodems..
Tot het tegendeel is bewezen, wordt dibenzalaceton als een relatief veilige verbinding beschouwd, aangezien de lage reactiviteit ervan geen reden is voor risico's of grotere voorzorgsmaatregelen..
Referenties
- Morrison, R. T. en Boyd, R, N. (1987). Organische chemie. 5e editie. Redactioneel Addison-Wesley Interamericana.
- Carey F. (2008). Organische chemie. (Zesde editie). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organische chemie. (10e editie.). Wiley plus.
- Wikipedia. (2020). Dibenzylideenaceton. Hersteld van: en.wikipedia.org
- Nationaal centrum voor informatie over biotechnologie. (2020). Dibenzylideenaceton. PubChem-database., CID = 640180. Hersteld van: pubchem.ncbi.nlm.nih.gov
- Organische syntheses. (2020). Dibenzalaceton. Hersteld van: orgsyn.org
- Dibenzalaceton door Aldol Condensation. Hersteld van: web.mnstate.edu


Niemand heeft nog op dit artikel gereageerd.