
Natriumdodecylsulfaat (SDS) structuur, eigenschappen, gebruik
De natriumdodecylsulfaat (SDS), is een anionisch, synthetisch en amfifiel organisch zout. Het apolaire en hydrofobe deel komt overeen met de koolwaterstofketen; terwijl het polaire en hydrofiele deel te wijten is aan sulfaat, met een negatieve lading.
SDS is een oppervlakteactieve stof: de moleculen ervan worden op het oppervlak van waterige oplossingen geplaatst, waardoor de oppervlaktespanning afneemt. Dankzij deze functie kan het worden gebruikt in shampoo, tandpasta, zeep en andere artikelen voor persoonlijke verzorging en huishoudelijke schoonmaakmiddelen..
Natriumdodecylsulfaat bindt zich aan het eiwit en zorgt ervoor dat het zich ontvouwt en een langwerpige vorm krijgt. De sulfaatgroepen worden blootgesteld aan water en nemen negatieve ladingen op, waarvan het aantal evenredig is met hun molecuulgewicht..
Om deze reden maakt SDS de bepaling van de molecuulgewichten van eiwitten door polyacrylamide-elektroforese mogelijk..
Hoewel een mogelijk carcinogeen effect van SDS wordt vermoed, is dit niet overtuigend aangetoond. SDS kan huid- en oogirritatie veroorzaken zoals andere wasmiddelen..
Artikel index
- 1 Structuur van het SDS
- 1.1 Kristallen
- 1.2 Micellen
- 2 Eigenschappen
- 2.1 Namen
- 2.2 Moleculaire formule
- 2.3 Molaire massa
- 2.4 Fysieke beschrijving
- 2.5 Geur
- 2.6 Smeltpunt
- 2.7 Oplosbaarheid in water
- 2.8 Dichtheid
- 2.9 Stabiliteit
- 2.10 Ontleding
- 2.11 Oppervlaktespanning
- 2.12 Kritische molaire concentratie
- 3 toepassingen
- 3.1 Persoonlijke verzorging en thuis schoonmaken
- 3.2 Diergeneeskunde en humane geneeskunde
- 3.3 In het laboratorium
- 3.4 Additief voor levensmiddelen
- 3.5 Industrie
- 4 Risico's
- 5 referenties
Structuur van het SDS
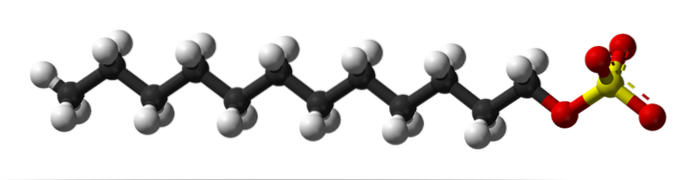
In de eerste afbeelding werd het SDS-molecuul getoond met een bolletjes- en staafjesmodel. Zoals te zien is, heeft het een hydrofobe en niet-polaire koolzuurhoudende staart (zwarte en witte bollen); en tegelijkertijd een poolhoofd, dankzij de aanwezigheid van de groep -SO4- (gele en rode bollen).
Hoewel niet getoond, zou er een paarse bol moeten zijn die het Na kation voorstelt+, direct naast de -SO-groep4-, elektrostatisch op elkaar inwerken.
Dat gezegd hebbende, is het gemakkelijk in te zien waarom deze verbinding amfifiel is; en ook een anionische oppervlakteactieve stof, aangezien de lading van SDS negatief is en naast Na ook andere kationen kan aantrekken+.
Het molecuul geeft de verkeerde indruk star te zijn, een onwrikbare lineaire structuur. Het is echter precies het tegenovergestelde. De SDS kan worden vergeleken met een "worm", wiens koolzuurhoudende staart meerdere trillingen en rotaties van zijn enkele bindingen vertoont. Hierdoor kan het verschillende vormen of plooien in het midden aannemen; in water bijvoorbeeld.
Kristallen
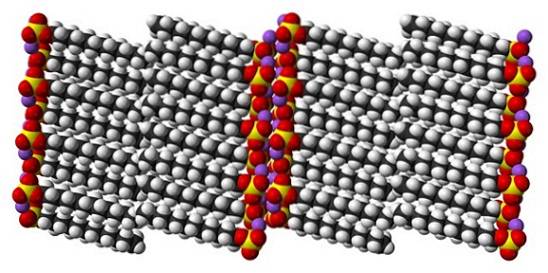
Hoewel het waar is dat natriumdodecylsulfaat een dynamisch molecuul is, hoeft het in vaste toestand niet te veel te bewegen en gedraagt het zich als een "eenvoudig" staafje. En dus wordt elk molecuul of elke staaf zo gepositioneerd dat de interacties tussen de carbonaatstaarten en tegelijkertijd die van hun ionische ladingen toenemen..
Het resultaat is de vorming van een monoklien kristal, waarbij de SDS-moleculen worden verpakt in verschillende kolommen met staven (bovenste afbeelding). De intermoleculaire krachten die ze binden zijn zodanig dat deze kristallen een temperatuur van 206ºC nodig hebben om in de vloeibare fase te smelten..
Micellen
Buiten het comfort van zijn kristallen kan het SDS-molecuul niet langer stilzitten; begint zijn staart te verdraaien om interacties met de buitenomgeving te vergroten of te verkleinen.
Als dit medium water is, treedt een fenomeen op dat micelvorming wordt genoemd: de koolzuurhoudende en hydrofobe staarten voegen zich samen om elkaar te bewapenen, terwijl de polaire koppen, de -SO groepen4-, blijven op het oppervlak in wisselwerking met H-moleculentweeOF.
De micel krijgt dan een afgeplatte ellipsoïde morfologie (zoals de aarde, maar meer afgeplat). In het glas zijn ze als blokken van staven, en in een waterig medium als ellipsoïde micellen. Wat als het medium olieachtig was? De micel zou worden omgekeerd: de poolkoppen SO4- zouden naar de kern gaan, terwijl hun koolzuurhoudende staarten zouden worden blootgesteld aan de olie.
Eigendommen
Namen
- Natriumdodecylsulfaat (SDS).
- Natriumlaurylsulfaat (SLS).
Moleculaire formule
C12H.25OF4SNa.
Molaire massa
288.378 g / mol.
Fysieke beschrijving
Diverse presentaties: droog poeder, vloeibaar of nat vast. De kristallen hebben een witte of crèmekleurige kleur.
Geur
Vage geur van vettige stoffen, geurloos.
Smeltpunt
206 ºC.
Oplosbaarheid in water
1 105 mg / L. 1 g opgelost in 10 ml opaalachtige oplossing.
Dichtheid
1,01 g / cm3.
Stabiliteit
Stabiel onder de aanbevolen opslagomstandigheden.
Ontleding
Bij verhitting tot ontbinding geeft het een witte rook van zwaveloxide en natriumoxide af.
Oppervlaktespanning
39,5 dyne / cm bij 25 ° C.
Kritische molaire concentratie
Het is 8,2 mM in zuiver water van 25 ºC.
Toepassingen
Persoonlijke verzorging en huisreiniging
Dodecylsulfaat is een oppervlakteactieve stof die in veel producten wordt gebruikt, zoals handzepen, schuimbaden, scheerschuim enz. Het wordt ook gebruikt om moeilijk te verwijderen vlekken uit kleding te verwijderen, vloeren en badkamers te reinigen, keukenartikelen te schrobben, enz..
Diergeneeskunde en menselijke geneeskunde
Het wordt gebruikt als een afweermiddel tegen vlooien en teken, aanwezig bij dieren. Het wordt ook gebruikt als bevochtiger in sommige antibiotica, voor oraal of plaatselijk gebruik..
SDS is microbicide tegen omhulde virussen, zoals HIV, type 1 en 2, en het herpes simplex-virus (HSV-2). Het werkt ook op niet-omhulde virussen: papillomavirus, reovirus, rotavirus en poliovirus. Dit gebruik is echter niet goedgekeurd..
Het gebruik van SDS als douche is voorgesteld om bescherming te bieden tegen seksueel overdraagbare virussen. Ook bij de verwerking van moedermelk om de mogelijkheid van HIV-overdracht via borstvoeding te elimineren of te verminderen.
Naast zijn antivirale werking werkt SDS in op pathogene bacteriën en schimmels. SDS verwijdert resistentie tegen geneesmiddelen en geslachtsoverdrachtsfactoren van E. coli; en blokkeert de groei van talrijke grampositieve bacteriën.
Op het laboratorium
SDS bindt zich aan eiwitten en veroorzaakt hun denaturatie, waardoor ze worden voorzien van negatieve ladingen en een conformatieverandering. Dit maakt de bepaling van hun molecuulgewichten door polyacrylamide-elektroforese mogelijk..
SDS wordt ook gebruikt bij de bereiding van hersenweefselmonsters voor gebruik bij lichtmicroscopie. Het wordt ook gebruikt bij de bereiding van bloedmonsters voor het tellen van het aantal erytrocyten..
SDS wordt gebruikt bij de zuivering van nucleïnezuren, vanwege zijn vermogen om membranen op te lossen en zijn remmende werking op de activiteit van RNase- en DNase-enzymen.
Bovendien wordt SDS gebruikt bij de karakterisering van quaternaire ammoniumverbindingen..
Additief voor levensmiddelen
SDS wordt gebruikt als emulgator en verdikkingsmiddel in voedingsmiddelen. Verbetert de stabiliteit en textuur van gebakken goederen. Bovendien wordt het gebruikt als hulpmiddel bij het kloppen van droge eiproducten..
Industrie
SDS wordt gebruikt in de galvanische industrie, met name nikkel en zink; als emulgator en penetrant in vernis en verfverwijderaar; bij de formulering van spuitgegoten explosieven; en in vaste raketstuwstoffen als schuimmiddel.
Risico's
Constante blootstelling aan SDS kan huidhyperplasie bij cavia's veroorzaken. Konijnen en mensen zijn minder vatbaar voor deze verwondingen. Direct contact met SDS in een concentratie ≤ 20% kan matige ontsteking en huidirritatie veroorzaken.
Aan de andere kant kan langdurige blootstelling aan SDS dermatitis veroorzaken, met tekenen van roodheid, zwelling en blaarvorming..
SDS kan bij contact oogirritatie veroorzaken. Het kan bij sommige mensen ook zeer reactief zijn en irritatie van de luchtwegen en ademnood bij inademing veroorzaken..
In zeldzame gevallen kan inname van SDS bijtend letsel veroorzaken. Maar het is gemeld bij kinderen die SDS hebben ingenomen, waarbij zich snel hevig braken, CZS-depressie en ademnood ontwikkelden..
In SDS zijn geen aanwijzingen gevonden voor genotoxiciteit of teratogene werking. Bij 242 patiënten met eczemateuze dermatitis bleek 6,4% van de patiënten een allergie te hebben, toe te schrijven aan het gebruik van de SDS.
Referenties
- Structurele gegevens van L. A. Smith, R. B. Hammond, K. J. Roberts, D. Machin, G. McLeod (2000). Bepaling van de kristalstructuur van watervrij natriumdodecylsulfaat met behulp van een combinatie van synchrotron straling, poederdiffractie en moleculaire modelleringstechnieken. Journal of Molecular Structure 554 (2-3): 173-182. DOI: 10.1016 / S0022-2860 (00) 00666-9.
- Wikipedia. (2019). Natriumdodecylsulfaat. Hersteld van: en.wikipedia.org
- Nationaal centrum voor informatie over biotechnologie. (2019). Natriumdodecylsulfaat. PubChem-database. CID = 3423265. Hersteld van: pubchem.ncbi.nlm.nih.gov
- Hammouda B. (2013). Temperatuureffect op de nanostructuur van SDS-micellen in water. Journal of research of the National Institute of Standards and Technology, 118, 151-167. doi: 10.6028 / jres.118.008
- Elsevier. (2019). Natriumdodecylsulfaat. Science Direct. Hersteld van: sciencedirect.com
- Kumar, S., Thejasenuo, J. K. en Tsipila, T. (2014). Toxicologische effecten van natriumdodecylsulfaat. Journal of Chemical and Pharmaceutical Research 6 (5): 1488-1492.
- Toxicologie Datanetwerk. (s.f.). Natriumlaurylsulfaat. Toxnet. Hersteld van: toxnet.nlm.nih.gov



Niemand heeft nog op dit artikel gereageerd.