
Chemische bindingseigenschappen, hoe ze worden gevormd, typen
De Chemische binding het is de kracht die erin slaagt de atomen waaruit de materie bestaat bijeen te houden. Elk type materie heeft een karakteristieke chemische binding, die bestaat uit de deelname van een of meer elektronen. Zo verschillen de krachten die atomen in gassen verenigen bijvoorbeeld van metalen.
Alle elementen van het periodiek systeem (met uitzondering van helium en de lichte edelgassen) kunnen chemische bindingen met elkaar vormen. De aard hiervan wordt echter gewijzigd, afhankelijk van de elementen waaruit de elektronen waaruit ze bestaan afkomstig zijn. Een essentiële parameter om het type bindingen te verklaren, is elektronegativiteit.
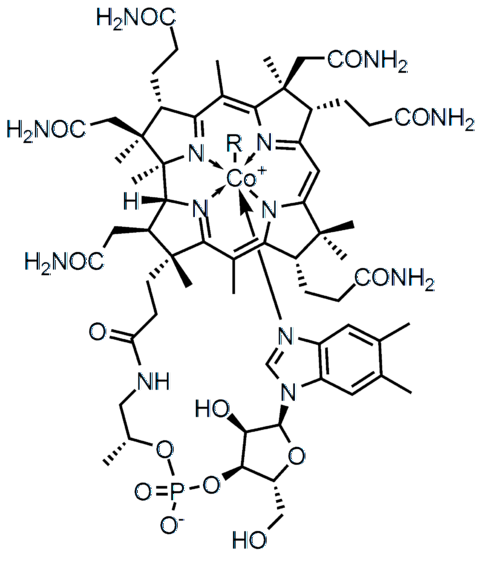
Het verschil in elektronegativiteit (ΔE) tussen twee atomen bepaalt niet alleen het type chemische binding, maar ook de fysisch-chemische eigenschappen van de verbinding. De zouten worden gekenmerkt door ionische bindingen (hoge ΔE), en veel van de organische verbindingen, zoals vitamine B12 (bovenste afbeelding), covalente bindingen (ΔE laag).
In de hogere moleculaire structuur vertegenwoordigt elk van de lijnen een covalente binding. De wiggen geven aan dat de link uit het vlak komt (richting de lezer), en de onderstreepte achter het vlak (weg van de lezer). Merk op dat er dubbele bindingen (=) en een kobaltatoom zijn gecoördineerd met vijf stikstofatomen en één R zijketen.
Maar waarom ontstaan zulke chemische bindingen? Het antwoord ligt in de energetische stabiliteit van de deelnemende atomen en elektronen. Deze stabiliteit moet de elektrostatische afstoting tussen elektronenwolken en kernen in evenwicht brengen, en de aantrekkingskracht die een kern uitoefent op de elektronen van het naburige atoom..
Artikel index
- 1 Definitie van de chemische binding
- 2 kenmerken
- 3 Hoe worden chemische bindingen gevormd?
- 3.1 Homonucleaire verbindingen A-A
- 3.2 Heteronucleaire verbindingen A-B
- 4 soorten chemische bindingen
- 4.1 -Covalente obligatie
- 4.2 -Ionische binding
- 4.3 Metaalbinding
- 5 Voorbeelden van links
- 6 Belang van de chemische binding
- 7 referenties
Definitie van de chemische binding
Veel auteurs hebben definities gegeven van de chemische binding. Van al deze was de belangrijkste die van de fysicochemicus G. N. Lewis, die de chemische binding definieerde als de deelname van een paar elektronen tussen twee atomen. Als atomen A en B een enkel elektron kunnen bijdragen, dan vormt zich tussen hen de enkele binding A: B of A-B.
Vóór de vorming van een binding zijn zowel A als B gescheiden door een onbepaalde afstand, maar bij het binden is er nu een kracht die ze bij elkaar houdt in de diatomische verbinding AB en een bindingsafstand (of lengte).
Kenmerken
Wat zijn de kenmerken van deze kracht die de atomen bij elkaar houdt? Deze zijn meer afhankelijk van het type verbinding tussen A en B dan van hun elektronische structuren. De A-B-link is bijvoorbeeld directioneel. Wat betekent het? Dat de kracht die wordt uitgeoefend door de vereniging van het elektronenpaar kan worden weergegeven op een as (alsof het een cilinder is).
Ook heeft deze band energie nodig om te verbreken. Deze hoeveelheid energie kan worden uitgedrukt in de eenheden kJ / mol of cal / mol. Zodra voldoende energie is toegepast op verbinding AB (bijvoorbeeld door warmte), zal deze dissociëren in de oorspronkelijke A- en B-atomen..
Hoe stabieler de binding, hoe meer energie het kost om de gebonden atomen te scheiden..
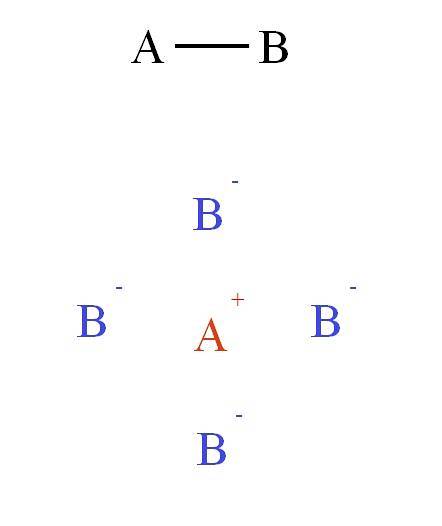
Aan de andere kant, als de binding in verbinding AB ionisch was, zou A+B-, dan zou het een niet-directionele kracht zijn. Waarom? Omdat+ oefent een aantrekkingskracht uit op B- (en vice versa) dat meer afhangt van de afstand die beide ionen in de ruimte scheidt dan van hun relatieve locatie.
Dit aantrekkings- en afstotingsveld brengt andere ionen samen om het zogenaamde kristalrooster te vormen (bovenste afbeelding: kation A+ ligt omgeven door vier anionen B-, en deze vier kationen A+ enzovoorts).
Hoe worden chemische bindingen gevormd?
Homonucleaire verbindingen A-A
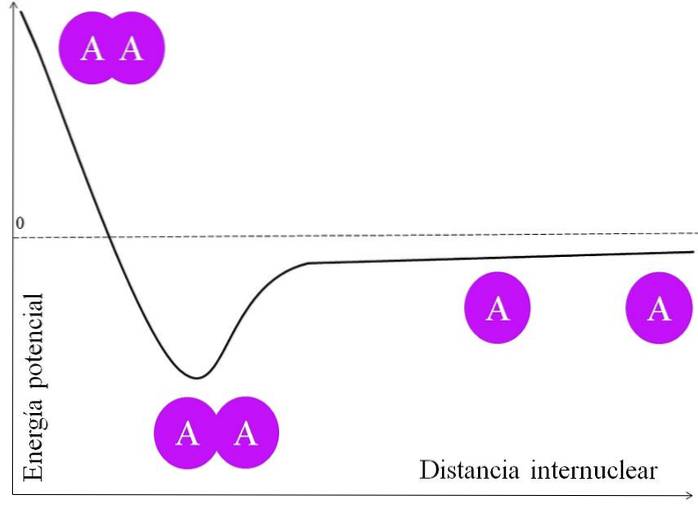
Om een elektronenpaar een binding te laten vormen, zijn er veel dingen die eerst moeten worden overwogen. De kernen, zeg maar die van A, hebben protonen en zijn dus positief. Wanneer twee A-atomen erg ver uit elkaar staan, dat wil zeggen op een grote internucleaire afstand (bovenste afbeelding), ervaren ze geen enkele aantrekking.
Als de twee A-atomen hun kernen naderen, trekken ze de elektronenwolk van het naburige atoom (de paarse cirkel) aan. Dit is de aantrekkingskracht (A op de aangrenzende paarse cirkel). De twee kernen van A stoten elkaar echter af omdat ze positief zijn, en deze kracht verhoogt de potentiële energie van de binding (verticale as).
Er is een internucleaire afstand waarin de potentiële energie een minimum bereikt; dat wil zeggen, zowel de aantrekkende als afstotende krachten zijn in evenwicht (de twee A-atomen in het onderste deel van de afbeelding).
Als deze afstand na dit punt afneemt, zal de binding ervoor zorgen dat de twee kernen elkaar met grote kracht afstoten, waardoor de A-A-verbinding wordt gedestabiliseerd..
Dus om de band te vormen, moet er een energetisch voldoende internucleaire afstand zijn; en bovendien moeten de atoomorbitalen elkaar correct overlappen om de elektronen te laten binden.
Heteronucleaire verbindingen A-B
Wat als in plaats van twee atomen van A, een van A en de andere van B zouden samenkomen? In dit geval zou de bovenste grafiek veranderen omdat een van de atomen meer protonen zou hebben dan de andere, en de elektronenwolken zouden verschillende afmetingen hebben..
Omdat de A-B-binding op de juiste internucleaire afstand wordt gevormd, zal het elektronenpaar voornamelijk in de buurt van het meest elektronegatieve atoom worden gevonden. Dit is het geval met alle heteronucleaire chemische verbindingen, die de overgrote meerderheid vormen van degenen die bekend zijn (en bekend zullen worden).
Hoewel niet diepgaand vermeld, zijn er talrijke variabelen die rechtstreeks van invloed zijn op hoe atomen naderen en chemische bindingen worden gevormd; sommige zijn thermodynamisch (is de reactie spontaan?), elektronisch (hoe vol of leeg zijn de orbitalen van de atomen) en andere kinetisch.
Soorten chemische bindingen
Links hebben een reeks kenmerken die ze van elkaar onderscheiden. Verschillende van hen kunnen worden ingekaderd in drie hoofdclassificaties: covalent, ionisch of metaalachtig.
Hoewel er verbindingen zijn waarvan de bindingen tot een enkel type behoren, bestaan veel in feite uit een combinatie van karakters van elk. Dit feit is te wijten aan het verschil in elektronegativiteit tussen de atomen die de bindingen vormen. Sommige verbindingen kunnen dus covalent zijn, maar hebben een bepaald ionisch karakter in hun bindingen..
Evenzo zijn het type binding, de structuur en de moleculaire massa sleutelfactoren die de macroscopische eigenschappen van de materie bepalen (helderheid, hardheid, oplosbaarheid, smeltpunt, enz.).
-Covalente binding
Covalente bindingen zijn tot dusverre verklaard. Daarin moeten twee orbitalen (elk één elektron) overlappen met de kernen die op een geschikte internucleaire afstand zijn gescheiden..
Volgens de moleculaire orbitaaltheorie (TOM), als de overlapping van de orbitalen frontaal is, vormt zich een sigma σ-binding (ook wel een eenvoudige of eenvoudige binding genoemd). Terwijl als de orbitalen worden gevormd door laterale en loodrechte overlappingen ten opzichte van de internucleaire as, we de π-bindingen (dubbel en drievoudig) hebben:
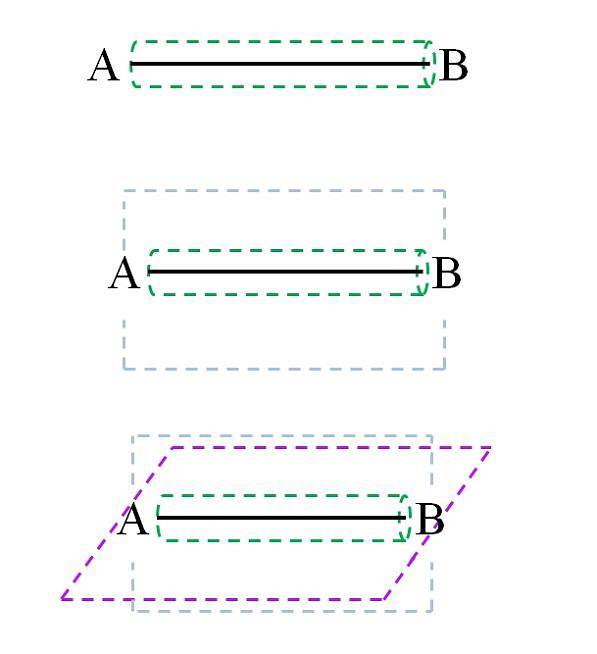
Eenvoudige link
De σ-binding, zoals te zien is in de afbeelding, wordt gevormd langs de internucleaire as. Hoewel niet getoond, kunnen A en B andere bindingen hebben, en dus hun eigen chemische omgeving (verschillende delen van de moleculaire structuur). Dit type link wordt gekenmerkt door zijn roterende kracht (groene cilinder) en omdat hij de sterkste is.
De enkele binding in het waterstofmolecuul kan bijvoorbeeld roteren op de internucleaire (H-H) as. Evenzo kan een hypothetisch molecuul CA-AB het doen..
Links C-A, A-A en A-B draaien; maar als C of B atomen zijn of een groep volumineuze atomen, wordt de A-A-rotatie sterisch belemmerd (omdat C en B zouden botsen).
Enkele bindingen worden in praktisch alle moleculen aangetroffen. Hun atomen kunnen elke chemische hybridisatie hebben zolang de overlapping van hun orbitalen frontaal is. Terug naar de structuur van vitamine B12, een enkele regel (-) geeft een enkele link aan (bijvoorbeeld -CONH linkstwee.
Dubbele link
De dubbele binding vereist dat de atomen (meestal) sp-hybridisatie hebbentwee. De pure p-binding, loodrecht op de drie hybride sp-orbitalentwee, vormt de dubbele binding, die verschijnt als een grijsachtig vel.
Merk op dat zowel de enkele binding (groene cilinder) als de dubbele binding (grijze plaat) tegelijkertijd naast elkaar bestaan. In tegenstelling tot enkele bindingen hebben dubbele bindingen echter niet dezelfde vrijheid van rotatie rond de internucleaire as. Dit komt omdat om te roteren de schakel (of de folie) moet breken; proces dat energie nodig heeft.
Ook is de A = B-binding reactiever dan A-B. De lengte is korter en de atomen A en B bevinden zich op een kortere internucleaire afstand; daarom is er een grotere afstoting tussen beide kernen. Het verbreken van zowel de enkele als de dubbele bindingen vereist meer energie dan nodig is om de atomen in het A-B-molecuul te scheiden..
In de structuur van vitamine B12 verschillende dubbele bindingen kunnen worden waargenomen: C = O, P = O, en binnen de aromatische ringen.
Drievoudige binding
De drievoudige binding is zelfs korter dan de dubbele binding en de rotatie ervan wordt energetisch meer belemmerd. Daarin worden twee loodrechte π-bindingen gevormd (de grijsachtige en paarse vellen), evenals een enkele binding.
Normaal gesproken moet de chemische hybridisatie van de atomen van A en B sp zijn: twee sp-orbitalen 180º uit elkaar, en twee zuivere p-orbitalen loodrecht op de eerste. Merk op dat een drievoudige binding eruit ziet als een peddel, maar zonder rotatiekracht. Deze binding kan eenvoudig worden weergegeven als A≡B (N≡N, stikstofmolecuul Ntwee.
Van alle covalente bindingen is dit de meest reactieve; maar tegelijkertijd degene die meer energie nodig heeft voor de volledige scheiding van zijn atomen (· A: +: B ·). Als vitamine B12 een drievoudige binding had binnen zijn moleculaire structuur, zou het farmacologische effect drastisch veranderen.
Zes elektronen nemen deel aan drievoudige bindingen; in dubbelen, vier elektronen; en in het simpele of simpele, twee.
De vorming van een of meer van deze covalente bindingen hangt af van de elektronische beschikbaarheid van de atomen; dat wil zeggen, hoeveel elektronen hebben hun orbitalen nodig om een octet van valentie te verwerven.
Niet-polaire binding
Een covalente binding bestaat uit het gelijk delen van een elektronenpaar tussen twee atomen. Maar dit is alleen strikt waar in het geval dat beide atomen gelijke elektronegativiteiten hebben; dat wil zeggen, dezelfde neiging om elektronendichtheid uit zijn omgeving aan te trekken tot een composiet.
Niet-polaire bindingen worden gekenmerkt door een nul-elektronegativiteitsverschil (ΔE≈0). Dit gebeurt in twee situaties: in een homonucleaire verbinding (Atwee), of als de chemische omgevingen aan beide zijden van de verbinding gelijkwaardig zijn (H.3C-CH3, ethaan molecuul).
Voorbeelden van niet-polaire bindingen zijn te zien in de volgende verbindingen:
-Waterstof (H-H)
-Zuurstof (O = O)
-Stikstof (N≡N)
-Fluor (F-F)
-Chloor (Cl-Cl)
-Acetyleen (HC≡CH)
Polaire banden
Wanneer er een duidelijk verschil is in elektronegativiteit ΔE tussen beide atomen, wordt een dipoolmoment gevormd langs de bindingsas: Aδ+-Bδ-. In het geval van de heteronucleaire verbinding AB is B het meest elektronegatieve atoom en daarom heeft het een hogere elektronendichtheid δ-; terwijl A, de minst elektronegatieve, ladingsdeficiëntie δ+.
Om de polaire bindingen te laten ontstaan, moeten twee atomen met verschillende elektronegativiteit samenkomen; en dus heteronucleaire verbindingen vormen. A-B lijkt op een magneet: het heeft een positieve en een negatieve pool. Hierdoor kan het interageren met andere moleculen door middel van dipool-dipoolkrachten, waaronder waterstofbruggen..
Water heeft twee polaire covalente bindingen, H-O-H, en de moleculaire geometrie is hoekig, waardoor het dipoolmoment toeneemt. Als de geometrie lineair zou zijn, zouden de oceanen verdampen en zou het water een lager kookpunt hebben.
Het feit dat een verbinding polaire bindingen heeft, betekent niet dat het polair is. Bijvoorbeeld tetrachloorkoolstof, CCl4, heeft vier polaire C-Cl-bindingen, maar vanwege hun tetraëdrische opstelling wordt het dipoolmoment vectorieel geannuleerd.
Datief- of coördinatielinks
Wanneer een atoom een paar elektronen opgeeft om een covalente binding te vormen met een ander atoom, dan spreken we van een datief- of coördinatiebinding. Bijvoorbeeld met B: het beschikbare elektronenpaar, en A (of A+), een elektronische vacature, wordt de schakel B: A gevormd.
In de structuur van vitamine B12 de vijf stikstofatomen zijn door dit type covalente binding aan het metaalcentrum van Co gebonden. Deze stikstofatomen geven hun vrije elektronenpaar af aan het Co-kation.3+, het metaal met hen coördineren (Co3+: N-)
Een ander voorbeeld is te vinden in de protonering van een ammoniakmolecuul om ammoniak te vormen:
H.3N: + H+ => NH4+
Merk op dat het in beide gevallen het stikstofatoom is dat de elektronen bijdraagt; daarom treedt de datief of coördinatie covalente binding op wanneer alleen een atoom het elektronenpaar bijdraagt.
Op dezelfde manier kan het watermolecuul worden geprotoneerd om het hydronium (of oxonium) kation te worden:
H.tweeO + H+ => H3OF+
In tegenstelling tot het ammoniumkation heeft hydronium nog steeds een vrij elektronenpaar (H.3OF:+het is echter erg moeilijk om een ander proton te accepteren om de onstabiele hydroniumdicatie H te vormen4OFtwee+.
-Ionbinding

Afgebeeld is een witte zoutheuvel. De zouten worden gekenmerkt door kristallijne structuren, dat wil zeggen symmetrisch en geordend; hoge smelt- en kookpunten, hoge elektrische geleidbaarheid bij smelten of oplossen, en ook zijn ionen sterk gebonden door elektrostatische interacties.
Deze interacties vormen de zogenaamde ionische binding. In de tweede afbeelding werd een kation A getoond+ omgeven door vier anionen B-, maar dit is een 2D-weergave. In drie dimensies, A+ zou andere anionen moeten hebben B- voorwaarts en achter het vliegtuig, verschillende structuren vormend.
Dus A+ het kan zes, acht of zelfs twaalf buren hebben. Het aantal buren dat een ion in een kristal omringt, staat bekend als het coördinatiegetal (NC). Voor elke N.C is een soort kristallijne ordening geassocieerd, die op zijn beurt een vaste fase van het zout vormt.
De symmetrische en gefacetteerde kristallen die in de zouten worden gezien, zijn te wijten aan het evenwicht dat tot stand is gebracht door de aantrekkingsinteracties (A+ B-) en afstoting (A+ NAAR+, B- B-) elektrostatisch.
Opleiding
Maar waarom A + en B-, of Na+ en Cl-, geen covalente Na-Cl-bindingen vormen? Omdat het chlooratoom veel elektronegatiever is dan natriummetaal, dat ook wordt gekenmerkt door het heel gemakkelijk opgeven van zijn elektronen. Wanneer deze elementen elkaar ontmoeten, reageren ze exotherm om tafelzout te produceren:
2Na (s) + Cltwee(g) => 2NaCl (s)
Twee natriumatomen geven hun enige valentie-elektron (Na) op aan het diatomische molecuul Cltwee, om de Cl-anionen te vormen-.
De interacties tussen natriumkationen en chloride-anionen, hoewel ze een zwakkere binding vertegenwoordigen dan covalente, zijn in staat ze sterk verenigd in de vaste stof te houden; en dit feit wordt weerspiegeld in het hoge smeltpunt van het zout (801 ° C).
Metalen binding

De laatste van de soorten chemische binding is van metaal. Dit is te vinden op elk onderdeel van metaal of legering. Het wordt gekenmerkt door speciaal te zijn en anders dan de anderen, vanwege het feit dat elektronen niet van het ene atoom naar het andere gaan, maar eerder reizen, zoals een zee, door het kristal van metalen..
Metaalatomen, om te zeggen koper, vermengen dus hun valentie-orbitalen met elkaar om geleidingsbanden te vormen; waardoor elektronen (s, p, d of f) rond de atomen gaan en ze stevig bij elkaar houden.
Afhankelijk van het aantal elektronen dat door het metallische kristal gaat, de orbitalen die voor de banden zijn voorzien en de pakking van zijn atomen, kan het metaal zacht zijn (zoals alkalimetalen), hard, glanzend of een goede geleider van elektriciteit en heet.
De kracht die de atomen van metalen bij elkaar houdt, zoals die van de kleine man in de afbeelding en zijn laptop, is groter dan die van zouten.
Dit kan experimenteel worden geverifieerd omdat de kristallen van de zouten vóór een mechanische kracht in verschillende helften kunnen worden verdeeld; terwijl een metalen onderdeel (bestaande uit zeer kleine kristallen) wordt vervormd.
Voorbeelden van links
De volgende vier verbindingen omvatten de soorten chemische bindingen die worden uitgelegd:
-Natriumfluoride, NaF (Na+F.-): ionisch.
-Natrium, Na: metaalachtig.
-Fluor, F.twee (F-F): niet-polair covalent, vanwege het feit dat er een nul ΔE is tussen beide atomen omdat ze identiek zijn.
-Waterstoffluoride, HF (H-F): polair covalent, aangezien fluor in deze verbinding meer elektronegatief is dan waterstof.
Er zijn verbindingen, zoals vitamine B12, met zowel polaire als ionische covalente bindingen (in de negatieve lading van de fosfaatgroep -PO4--In sommige complexe structuren, zoals metaalclusters, kunnen al deze soorten schakels zelfs naast elkaar bestaan.
Materie biedt in al zijn verschijningsvormen voorbeelden van chemische bindingen. Van de steen op de bodem van een vijver en het water eromheen, tot de padden die aan de randen kwaken.
Hoewel de bindingen eenvoudig kunnen zijn, maken het aantal en de ruimtelijke ordening van de atomen in de moleculaire structuur plaats voor een rijke diversiteit aan verbindingen..
Belang van de chemische binding
Wat is het belang van de chemische binding? Het onberekenbare aantal gevolgen dat de afwezigheid van de chemische binding zou ontketenen, onderstreept het enorme belang ervan in de natuur:
-Zonder dit zouden kleuren niet bestaan, omdat de elektronen geen elektromagnetische straling zouden absorberen. De stof- en ijsdeeltjes in de atmosfeer zouden verdwijnen en daarom zou de blauwe kleur van de lucht donker worden..
-Koolstof kon zijn eindeloze ketens niet vormen, waaruit biljoenen organische en biologische verbindingen voortkomen.
-Eiwitten konden niet eens worden gedefinieerd in hun samenstellende aminozuren. Suikers en vetten zouden verdwijnen, evenals eventuele koolstofverbindingen in levende organismen.
-De aarde zou zonder atmosfeer worden gelaten, omdat er bij afwezigheid van chemische bindingen in zijn gassen geen kracht zou zijn om ze bij elkaar te houden. Noch zou er de minste intermoleculaire interactie tussen hen zijn.
-De bergen zouden kunnen verdwijnen, omdat hun rotsen en mineralen, hoewel zwaar, hun atomen niet konden bevatten verpakt in hun kristallijne of amorfe structuren..
-De wereld zou bestaan uit solitaire atomen die niet in staat zijn om vaste of vloeibare substanties te vormen. Dit zou ook resulteren in het verdwijnen van alle transformatie van materie; dat wil zeggen, er zou geen chemische reactie zijn. Gewoon overal vluchtige gassen.
Referenties
- Harry B. Gray. (1965). Elektronen en chemische binding. W.A. BENJAMIN, INC. P 36-39.
- Whitten, Davis, Peck & Stanley. Chemie. (8e ed.). CENGAGE Leren, p 233, 251, 278, 279.
- Schip R. (2016). Chemische binding. Hersteld van: hyperphysics.phy-astr.gsu.edu
- Soorten chemische binding. (3 oktober 2006). Genomen uit: dwb4.unl.edu
- Vorming van chemische bindingen: de rol van elektronen. [Pdf]. Hersteld van: cod.edu
- Stichting CK-12. (s.f.). Vorming van energie en covalente binding. Hersteld van: chem.libretexts.org
- Quimitube. (2012). Coördinaten of datief covalente binding. Hersteld van: quimitube.com


Niemand heeft nog op dit artikel gereageerd.