
Sigma Link hoe het is gevormd, kenmerken en voorbeelden
De sigma link (weergegeven als σ) is een covalente unie, die wordt gekenmerkt door het delen van twee elektronen die optreedt tussen een paar atomen om de genoemde binding te vormen. Bovendien is dit een soort enkele binding, waarbij beide atomen door twee elektronen zijn verbonden om een enkele binding te vormen..
Wanneer twee of meer atomen worden gecombineerd om nieuwe moleculaire verbindingen te vormen, worden ze verbonden door middel van twee soorten bindingen: ionisch en covalent, waarvan de structuur afhangt van hoe de elektronen worden gedeeld tussen beide atomen die bij deze koppeling betrokken zijn..
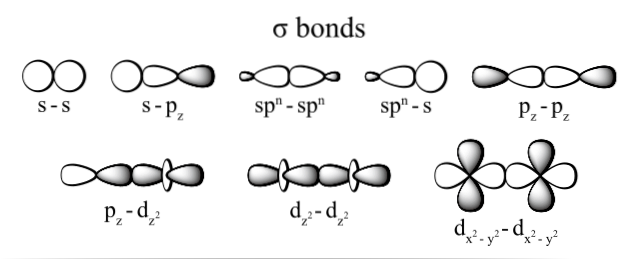
De verbinding die via de elektronen wordt gegenereerd, wordt tot stand gebracht dankzij de overlapping van de orbitalen die bij elk atoom horen (aan hun uiteinden), waarbij als orbitalen de ruimten worden begrepen waar het het meest waarschijnlijk is dat het elektron in het atoom wordt gelokaliseerd en die worden gedefinieerd door elektronen dichtheid.
Artikel index
- 1 Hoe wordt het gevormd?
- 1.1 Vorming van sigma-bindingen in verschillende chemische soorten
- 2 kenmerken
- 3 voorbeelden
- 4 referenties
Hoe wordt het gevormd?
Meestal is bekend dat de enkele binding tussen twee atomen equivalent is aan een enkele sigma-binding..
Evenzo ontstaan deze bindingen door de superpositie of overlapping op een frontale manier die optreedt tussen de uiteinden van de atomaire orbitalen van twee verschillende atomen..
Deze atomen waarvan de orbitalen elkaar overlappen, moeten naast elkaar liggen, zodat de individuele elektronen die tot elke atomaire orbitaal behoren, effectief kunnen binden en de binding kunnen vormen..
Vandaar het feit dat de elektronische distributie die zich manifesteert of de locatie van de dichtheid van de elektronen van elke superpositie een cilindrische symmetrie heeft rond de as die optreedt tussen de twee verbonden atomaire soorten..
In dit geval kan de zogenaamde sigma-orbitaal gemakkelijker worden uitgedrukt in termen van intramoleculaire bindingen die zich vormen binnen diatomische moleculen, waarbij wordt opgemerkt dat er ook verschillende soorten sigma-bindingen zijn..
De meest voorkomende soorten sigma-obligaties zijn: dztwee+dztwee, s + pz, pz+pz en s + s; waarbij het onderschrift z de as vertegenwoordigt die wordt gevormd door de gevormde band en elke letter (s, p en d) overeenkomt met een orbitaal.
Vorming van sigma-bindingen in verschillende chemische soorten
Wanneer we het hebben over moleculaire orbitalen, wordt verwezen naar de regio's die de hoogste elektronendichtheid accumuleren wanneer een dergelijke binding wordt gevormd tussen verschillende moleculen, die wordt verkregen door de combinatie van atomaire orbitalen..
Vanuit het oogpunt van de kwantummechanica hebben studies geconcludeerd dat moleculaire orbitalen die symmetrisch gelijk gedrag vertonen, feitelijk worden gecombineerd in mengsels (hybridisaties).
De betekenis van deze combinatie van orbitalen hangt echter nauw samen met de relatieve energieën die worden gemanifesteerd door moleculaire orbitalen die symmetrisch vergelijkbaar zijn..
In het geval van organische moleculen worden vaak cyclische soorten bestaande uit een of meer ringstructuren waargenomen, die vaak worden gevormd door een groot aantal sigma-type bindingen in combinatie met pi-type bindingen (meervoudige bindingen)..
In feite is het met behulp van eenvoudige wiskundige berekeningen mogelijk om het aantal sigma-bindingen dat aanwezig is in een moleculaire soort te bepalen..
Er zijn ook gevallen van coördinatieverbindingen (met overgangsmetalen), waarbij meerdere bindingen worden gecombineerd met verschillende klassen van bindingsinteracties, evenals moleculen die zijn opgebouwd uit verschillende soorten atomen (polyatomisch).
Kenmerken
Sigma-bindingen hebben unieke kenmerken die hen duidelijk onderscheiden van andere soorten covalente binding (pi-binding), waaronder het feit dat dit type binding de sterkste is onder de covalente chemische bindingen..
Dit komt doordat de overlap tussen de orbitalen direct, coaxiaal (of lineair) en frontaal plaatsvindt; dat wil zeggen, een maximale overlap wordt verkregen tussen de orbitalen.
Bovendien is de elektronische distributie op deze knooppunten voornamelijk geconcentreerd tussen de kernen van de atomaire soorten die worden gecombineerd..
Deze overlap van sigma-orbitalen vindt op drie mogelijke manieren plaats: tussen een paar zuivere orbitalen (s-s), tussen een zuivere orbitaal en een hybride type (s-sp), of tussen een paar hybride-type orbitalen (sp3- sp3.
Hybridisatie vindt plaats dankzij het mengsel van orbitalen van atomaire oorsprong van verschillende klassen, waarbij wordt verkregen dat de resulterende hybride orbitaal afhangt van de hoeveelheid van elk van de soorten zuivere startorbitalen (bijvoorbeeld sp3 = één zuivere s-orbitaal + drie zuivere p-type orbitalen).
Bovendien kan de sigma-binding onafhankelijk bestaan en vrije rotatiebeweging tussen een paar atomen toelaten..
Voorbeelden
Omdat de covalente binding de meest voorkomende soort binding tussen atomen is, wordt de sigma-binding in een groot aantal chemische soorten aangetroffen, zoals hieronder te zien is.
In twee atomen gasmoleculen - zoals waterstof (H.twee), zuurstof (Otwee) en stikstof (Ntwee) - er kunnen verschillende soorten binding optreden, afhankelijk van de hybridisatie van de atomen.
In het geval van waterstof is er een enkele sigma-binding die beide atomen verbindt (H-H), omdat elk atoom zijn enige elektron bijdraagt.
Aan de andere kant zijn in moleculaire zuurstof beide atomen verbonden door een dubbele binding (O = O) -dat wil zeggen een sigma-binding en een pi-binding, waardoor elk atoom zijn met drie paar overgebleven elektronen gepaard.
In plaats daarvan heeft elk stikstofatoom vijf elektronen in zijn buitenste energieniveau (valentieschil), dus ze zijn verbonden door een drievoudige binding (N≡N), wat de aanwezigheid van een sigma-binding en twee pi-bindingen en een paar gepaarde elektronen impliceert. in elk atoom.
Op dezelfde manier komt het voor in cyclische verbindingen met enkele of meervoudige bindingen en in allerlei moleculen waarvan de structuur is opgebouwd uit covalente bindingen..
Referenties
- Wikipedia. (s.f.). Sigma-band. Opgehaald van en.wikipedia.org
- Chang, R. (2007). Chemistry, negende editie. Mexico: McGraw-Hill.
- ThoughtCo. (s.f.). Sigma Bond Chemistry-definitie. Opgehaald van thoughtco.com
- Britannica, E. (s.f.). Sigma-band. Opgehaald van britannica.com
- LibreTexts. (s.f.). Sigma- en Pi-obligaties. Opgehaald van chem.libretexts.org
- Srivastava, A. K. (2008). Organische chemie eenvoudig gemaakt. Opgehaald van books.google.co.ve



Niemand heeft nog op dit artikel gereageerd.