
Pauling schaal elektronegativiteit en energieverschil

De Pauling schaal is een willekeurige schaal die in de chemie wordt gebruikt om de elektronegativiteit van de elementen. Dit wordt gedefinieerd als de neiging van een bepaald atoom om elektronen aan te trekken in combinatie met een ander atoom.
In die zin hebben elementen met een hoge elektronegativiteit de neiging om gemakkelijk elektronen te winnen. Dit zijn de niet-metalen, terwijl het op hun beurt, minder elektronegatieve elementen zoals metalen, gemakkelijker is om elektronen op te geven.
Daarom, als je de elektronegativiteit van een element kent, heb je een idee van het type binding dat het kan vormen in combinatie met een ander. We zullen dit later zien met een numeriek voorbeeld..
Met deze informatie kunnen veel van de eigenschappen die een verbinding zal hebben, worden voorspeld, iets wat heel nuttig is in de experimentele chemie en voor de materiaalkunde, waar voortdurend nieuwe verbindingen worden gemaakt..
Het is echter gemakkelijk om duidelijk te maken dat, ondanks hoe belangrijk het is, er niet één manier is om elektronegativiteit te bepalen; De Pauling-schaal is slechts een van de verschillende manieren die worden voorgesteld om het te vinden, hoewel het een van de meest gebruikte is.
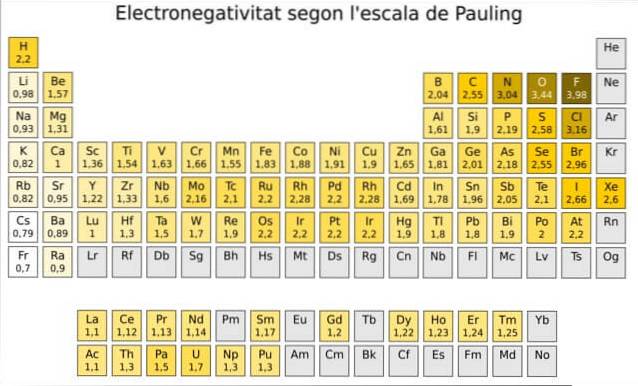
In feite is Pauling's een willekeurige schaal waarin een numerieke waarde wordt toegewezen aan elk element in het periodiek systeem, wat de elektronegativiteit weerspiegelt. We zien het in figuur 1, waar we de elektronegativiteit van elk element hebben, zoals toegewezen door de tweevoudig Nobelprijswinnaar Linus Pauling (1901-1994) rond 1939.
Artikel index
- 1 De elektronegativiteit van de elementen
- 1.1 Elektronegativiteit in het periodiek systeem
- 2 Bindend energieverschil
- 2.1 Vergelijkingen voor elektronegativiteit
- 3 Voorbeeld
- 3.1 Oplossing
- 4 referenties
De elektronegativiteit van de elementen
Pauling, samen met Don M. Yost, vond de elektronegativiteitswaarden empirisch, door middel van experimentele gegevens verkregen door het meten van bindingsenergieën..
Pauling kende het element fluor - boven en rechts van de tabel in figuur 1 - de hoogste elektronegativiteit toe, met het nummer 4.0. Dus wanneer fluor bindingen vormt, vertoont het de grootste neiging om elektronen van alle elementen aan te trekken..
De tweede is zuurstof met 3,5 en de derde is stikstof met 3,0. Beiden bevinden zich bovenaan en rechts van de tafel.
Aan de andere kant, aan het andere uiterste, is het minst elektronegatieve element cesium, waarvan het symbool Cs is, links van de tabel, waaraan Pauling het nummer 0,7 heeft toegewezen..
Elektronegativiteit in het periodiek systeem
In algemene zin en zoals te zien is in figuur 1, neemt de elektronegativiteit - en ionisatie-energie - toe van links naar rechts in het periodiek systeem. De algemene trend duidt ook op een afname bij het verplaatsen van boven naar beneden.
Daarom hebben we de meest elektronegatieve elementen in de rechterbovenhoek van de tabel: fluor, zuurstof, chloor, stikstof. De minst elektronegatieve - of de meest elektropositieve als je dat liever hebt - vind je aan de linkerkant: lithium, natrium, kalium en de andere elementen van groep 1 - de kolom helemaal links, die overeenkomt met de alkali- en aardalkalimetalen.-.
In elke kolom neemt de elektronegativiteit af naarmate het atoomnummer van het element toeneemt, behalve de overgangsmetalen in het midden, die deze trend niet volgen..
Een belangrijk punt om op te merken is dat elektronegativiteit relatief is, het is geen onveranderlijke eigenschap van elk element, en het wordt alleen gemeten met betrekking tot die van andere elementen. Het hangt sterk af van de oxidatietoestand, dus hetzelfde element kan verschillende elektronegativiteit vertonen, afhankelijk van het type verbinding dat het vormt..
Bindend energieverschil

In de chemie is een binding de manier waarop atomen, dezelfde of verschillende, samenkomen om moleculen te vormen. Tussen de atomen verschijnen krachten die ze op een stabiele manier bij elkaar houden.
Er zijn verschillende soorten koppelingen, maar hier worden er twee beschouwd:
-Covalent, waarbij atomen met vergelijkbare elektronegativiteiten een paar elektronen delen.
-Ionisch, frequent tussen atomen met verschillende elektronegativiteiten waarin elektrostatische aantrekkingskracht heerst.
Stel dat twee elementen A en B met elkaar moleculen kunnen vormen, aangeduid met AA en BB. En dat ze ook in staat zijn om samen te komen om een AB-verbinding te vormen, allemaal via een soort binding.
Dankzij de deelname van intermoleculaire krachten is er energie in de binding. De energie in binding AA is bijvoorbeeld EAA, in obligatie BB is het EBB en tenslotte in verbinding AB is het EAB.
Als het molecuul AB werd gevormd door een covalente binding, is de bindingsenergie theoretisch het gemiddelde van de energieën EAA en EBB
ENAB = ½ (E.AA + ENBB
Pauling berekende EAB voor verschillende verbindingen heeft hij het experimenteel gemeten en het verschil tussen beide waarden bepaald, die hij Δ noemde:
Δ = | (E.AB) gemeten - (E.AB) theoretisch | = | (E.AB) gemeten - ½ (EAA + ENBB
Pauling redeneerde als volgt: als Δ heel dicht bij 0 ligt, betekent dit dat de elektronegativiteiten van beide elementen vergelijkbaar zijn en dat de binding die hen verbindt covalent is. Maar als Δ niet klein is, dan is de binding tussen A en B niet zuiver covalent.
Hoe groter de absolute waarde van Δ, hoe groter het verschil tussen de elektronegativiteit van elementen A en B en daarom zal de binding die hen verbindt van het ionische type zijn. Later zal de lezer een voorbeeld vinden waarin, door Δ te berekenen, het mogelijk is om het type binding van een verbinding te bepalen.
Vergelijkingen voor elektronegativiteit
Ervan uitgaande dat het verschil in energie het signaal is dat de aard van de binding onderscheidt, voerde Pauling veel experimenten uit die hem ertoe brachten een empirische uitdrukking te creëren voor de relatieve elektronegativiteiten van twee elementen A en B die een molecuul vormen..
Door deze elektronegativiteit aan te duiden als χ (Griekse letter "chi"), definieerde Pauling Δ als volgt:
F.twee· Δ = [χ (A) - χ (B)]twee
χ (A) - χ (B) = f√Δ = 0,102√Δ
Merk op dat Δ een positieve grootheid is. De factor f = 0,102 die verschijnt door de vierkantswortel van Δ te vermenigvuldigen, is de conversiefactor tussen kJ (kilojoule) en eV (elektron-volt), beide energie-eenheden.
Als in plaats daarvan kilocalorieën en elektron-volt worden gebruikt, wordt het verschil in elektronegativiteiten uitgedrukt met een vergelijkbare formule maar met f = 0,208:
χ (A) - χ (B) = 0,208√Δ
Pauling begon met het toekennen van een waarde aan waterstof van 2,1, een eerdere waarde verkregen door chemicus Robert Mulliken. Hij koos dit element als uitgangspunt omdat het covalente banden vormt met vele anderen..
Met behulp van de bovenstaande vergelijking ging hij door met het toekennen van relatieve waarden aan de rest van de elementen. Hij realiseerde zich dus dat de elektronegativiteit toeneemt bij het verplaatsen van links naar rechts en van boven naar beneden in het periodiek systeem, zoals beschreven in de vorige paragraaf..
Voorbeeld
Hieronder staat een lijst met elementen: N, J, Y en M en hun respectieve elektronegativiteiten Χ volgens de Pauling-schaal:
-N: Χ = 4,0
-J: Χ = 1,5
-Y: Χ = 0,9
-M.: Χ = 1,6
Onder de volgende verbindingen gevormd met hen:
YJ, YN, MN en JM
Geef degene aan met het hoogste ionische karakter en degene wiens aard covalent is. Reden voor uw antwoord.
Oplossing
Volgens de criteria die door Pauling zijn vastgesteld, zal de verbinding met het grootste ionische karakter degene zijn met het grootste verschil tussen elektronegativiteiten, en dus een grotere waarde van Δ. Van zijn kant is de verbinding met het kleinste energieverschil degene met een covalente binding.
Vervolgens berekenen we hoeveel Δ voor elke verbinding waard is, als volgt:
Composiet YJ
Δ = [χ (Y) - χ (J)]twee = (0,9 - 1,5)twee = 0,36
Samengesteld YN
Δ = [χ (Y) - χ (N)]twee = (0,9 - 4,0)twee = 9,61
Composiet MN
Δ = [χ (M) - χ (N)]twee = (1,6 - 4,0)twee = 5,76
Composiet JM
Δ = [χ (J) - χ (M)]twee = (1,5 - 1,6)twee = 0,01
Uit de vorige resultaten volgt dat de ionische verbinding YN is, waarvan Δ = 9,61, terwijl de covalente verbinding JM is, met Δ = 0,01.
Referenties
- Chemie Libretexts. Pauling Elektronegativiteit. Hersteld van: chem.libretexts.org.
- IUPAC Gold Book. Elektronegativiteit. Hersteld van: goldbook.iupac.org.
- Salas-Banuet, G. De onbegrepen elektronegativiteit. Hersteld van: scielo.org.
- Wetenschappelijke teksten. Elektronegativiteit. Hersteld van: textscientificos.com.
- Whitten, K. 2010. Chemistry. 9e. Ed. Brooks / Cole. Cengage leren.
- Wikipedia. Covalente binding. Hersteld van: es.wikipedia.org.
- Wikipedia. Ionbinding. Hersteld van: es.wikipedia.org.



Niemand heeft nog op dit artikel gereageerd.