
Ethyleenglycol eigenschappen, chemische structuur, gebruik
De ethyleenglycol het is de eenvoudigste organische verbinding in de glycolfamilie. De chemische formule is CtweeH.6OFtwee, terwijl de structuurformule HOCH istwee-CHtweeOH. Een glycol is een alcohol die wordt gekenmerkt door twee hydroxylgroepen (OH) die zijn bevestigd aan twee naburige koolstofatomen in een alifatische keten.
Ethyleenglycol is een heldere, kleurloze en geurloze vloeistof. In de onderstaande afbeelding heb je een voorbeeld van hem in een potje. Bovendien heeft het een zoete smaak en is het erg hygroscopisch. Het is een enigszins vluchtige vloeistof, dus het oefent een zeer lage dampspanning uit, waarbij de dichtheid van de damp groter is dan de dichtheid van lucht..

Ethyleenglycol is een verbinding met een grote oplosbaarheid in water, naast mengbaar met veel organische verbindingen; zoals alifatische alcoholen met een korte keten, aceton, glycerol, enz. Dit komt door hun vermogen om waterstofbruggen te doneren en te accepteren van protische oplosmiddelen (die H hebben).
Ethyleenglycol polymeriseert tot vele verbindingen, waarvan de namen vaak worden afgekort tot PEG en een getal dat hun geschatte molecuulgewicht aangeeft. PEG 400 is bijvoorbeeld een relatief klein, vloeibaar polymeer. Terwijl grote PEG's witte vaste stoffen zijn met een vettig uiterlijk.
De eigenschap van ethyleenglycol om het smeltpunt te verlagen en het kookpunt van water te verhogen, maakt het gebruik ervan als koelmiddel en antistollingsmiddel in voertuigen, vliegtuigen en computerapparatuur mogelijk.
Artikel index
- 1 Eigenschappen
- 1.1 Namen
- 1,2 molaire massa
- 1.3 Fysiek voorkomen
- 1.4 Geur
- 1.5 Smaak
- 1.6 Dichtheid
- 1.7 Smeltpunt
- 1.8 Kookpunt
- 1.9 Oplosbaarheid in water
- 1.10 Oplosbaarheid in andere oplosmiddelen
- 1.11 Vlampunt
- 1.12 Dampdichtheid
- 1.13 Dampspanning
- 1.14 Ontleding
- 1.15 Opslagtemperatuur
- 1.16 Verbrandingswarmte
- 1.17 Verdampingswarmte
- 1.18 Oppervlaktespanning
- 1.19 Brekingsindex
- 1.20 Dissociatieconstante
- 1,21 pH
- 1.22 Verdelingscoëfficiënt octanol / water
- 2 Chemische structuur
- 3 Productie
- 3.1 Oxidatie van ethyleen
- 3.2 Hydrolyse van ethyleenoxide
- 3.3 Omega-proces
- 4 toepassingen
- 4.1 Koelvloeistof en antivries
- 4.2 Uitdroging
- 4.3 Vervaardiging van polymeren
- 4.4 Explosieven
- 4.5 Houtbescherming
- 4.6 Andere toepassingen
- 5 Vergiftiging en risico's
- 5.1 Symptomen bij blootstelling
- 5.2 Schade door inslikken
- 5.3 Ecologische gevolgen van ethyleenglycol
- 6 referenties
Eigendommen
Namen
Ethaan-1,2-diol (IUPAC), ethyleenglycol, monoethyleenglycol (MEG), 1-2-dihydroxyethaan.
Molaire massa
62,068 g / mol
Fysiek uiterlijk
Heldere, kleurloze en stroperige vloeistof.
Geur
Toilet
Smaak
Snoep
Dichtheid
1,1132 g / cm3
Smeltpunt
-12,9 ºC
Kookpunt
197,3 ºC
Oplosbaarheid in water
Mengbaar met water, sterk hygroscopisch mengsel.
Oplosbaarheid in andere oplosmiddelen
Mengbaar met lagere alifatische alcoholen (methanol en ethanol), glycerol, azijnzuur, aceton en soortgelijke ketonen, aldehyden, pyridine, koolteerbasen en oplosbaar in ether. Vrijwel onoplosbaar in benzeen en zijn homologen, gechloreerde koolwaterstoffen, petroleumether en oliën.
ontstekingspunt
111 ºC
Dampdichtheid
2.14 met betrekking tot lucht genomen als 1.
Dampdruk
0,092 mmHg bij 25 ° C (door extrapolatie).
Ontleding
Bij verhitting tot ontbinding geeft het bijtende en irriterende rook af.
Bewaar temperatuur
2-8 ºC
Verbrandingswarmte
1.189,2 kJ / mol
Warmte van verdamping
50,5 kJ / mol
Oppervlaktespanning
47,99 mN / m bij 25 ºC
Brekingsindex
1.4318 bij 20 ºC
Dissociatieconstante
pKa = 14,22 bij 25 ºC
pH
6 tot 7,5 (100 g / l water) bij 20 ºC
Verdelingscoëfficiënt octanol / water
Log P = - 1.69
Chemische structuur
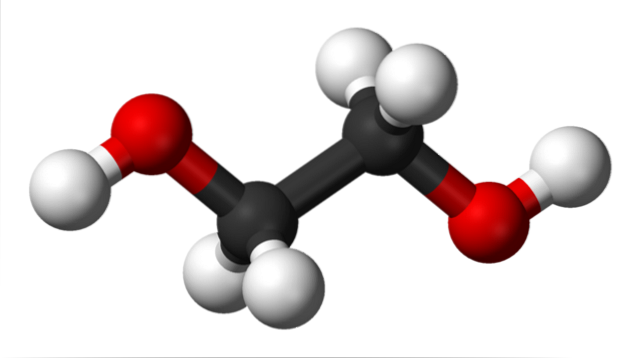
In de bovenste afbeelding hebben we het ethyleenglycolmolecuul weergegeven door een model van bollen en staven. De zwarte bollen komen overeen met de koolstofatomen, die hun C-C-skelet vormen, en aan hun uiteinden hebben we de rode en witte bollen voor respectievelijk de zuurstof- en waterstofatomen..
Het is een symmetrisch molecuul en op het eerste gezicht kan men denken dat het een permanent dipoolmoment heeft; hun C-OH-bindingen roteren echter, wat de dipool begunstigt. Het is ook een dynamisch molecuul dat constante rotaties en trillingen ondergaat en dankzij zijn twee OH-groepen in staat is waterstofbruggen te vormen of te ontvangen..
In feite zijn deze interacties verantwoordelijk voor ethyleenglycol met zo'n hoog kookpunt (197 ºC).
Wanneer de temperatuur daalt tot -13 ºC, smelten de moleculen samen in een orthorhombisch kristal, waar rotameren een belangrijke rol spelen; dat wil zeggen, er zijn moleculen waarvan de OH-groepen in verschillende richtingen zijn georiënteerd.
Productie
Ethyleen oxidatie
De eerste stap in de synthese van ethyleenglycol is de oxidatie van ethyleen tot ethyleenoxide. In het verleden heeft ethyleen gereageerd met hypochloorzuur om chloorhydrine te produceren. Dit werd vervolgens behandeld met calciumhydroxide om ethyleenoxide te produceren..
De chloorhydrine-methode is niet erg winstgevend en er is overgeschakeld op een methode van directe oxidatie van ethyleen in aanwezigheid van lucht of zuurstof, waarbij zilveroxide als katalysator wordt gebruikt..
Ethyleenoxide-hydrolyse
Hydrolyse van ethyleenoxide (EO) met water onder druk levert een ruw mengsel op. Het water-glycolmengsel wordt verdampt en gerecirculeerd, waarbij monoethyleenglycol wordt gescheiden van diethyleenglycol en triethyleenglycol door gefractioneerde destillatie..
De ethyleenoxidehydrolysereactie kan als volgt worden geschetst:
CtweeH.4O + HtweeO => OH-CHtwee-CHtwee-OH (ethyleenglycol of monoethyleenglycol)
Mitsubishi Chemical ontwikkelde een katalytisch proces, door het gebruik van fosfor, bij de omzetting van ethyleenoxide in monoethyleenglycol.
Omega-proces
In het Omega-proces wordt ethyleenoxide aanvankelijk omgezet in ethyleencarbonaat door reactie met kooldioxide (COtweeVervolgens wordt het ethyleencarbonaat onderworpen aan een katalytische hydrolyse om de monoethyleenglycol met 98% selectiviteit te verkrijgen.
Er is een relatief nieuwe methode voor de synthese van ethyleenglycol. Dit bestaat uit de oxidatieve carbonylering van methanol tot dimethyloxalaat (DMO) en de daaropvolgende hydrogenering tot ethyleenglycol..
Toepassingen
Koelvloeistof en antivries
Het mengsel van ethyleenglycol met water zorgt voor een verlaging van het vriespunt en een verhoging van het kookpunt, waardoor automotoren in de winter niet bevriezen en in de zomer oververhit raken..
Wanneer het percentage ethyleenglycol in het mengsel met water 70% bereikt, is het vriespunt -55 ºC, dus het ethyleenglycol-watermengsel kan worden gebruikt als koelvloeistof en bescherming tegen bevriezing in die omstandigheden waarin het kan voorkomen.
De lage vriestemperaturen van ethyleenglycoloplossingen maken het gebruik ervan als antivries in automotoren mogelijk; het ijsvrij maken van vliegtuigvleugels; en bij het ontdooien van de voorruiten.
Het wordt ook gebruikt om biologische monsters te bewaren die bij lage temperaturen worden bewaard, waardoor de vorming van kristallen wordt vermeden die de structuur van de monsters kunnen beschadigen..
Door het hoge kookpunt kunnen ethyleenglycoloplossingen worden gebruikt om lage temperaturen te handhaven in apparaten of apparatuur die warmte genereren tijdens het gebruik, zoals: auto's, computerapparatuur, airconditioners, enz..
Uitdroging
Ethyleenglycol is een zeer hygroscopische verbinding, waardoor het kan worden gebruikt voor de behandeling van gassen die uit de ondergrond worden gehaald en die een hoog gehalte aan waterdampen bevatten. De verwijdering van water uit aardgassen bevordert het efficiënte gebruik ervan in hun respectievelijke industriële processen..
Polymeerproductie
Ethyleenglycol wordt gebruikt voor de synthese van polymeren, zoals polyethyleenglycol (PEG), polyethyleentereftalaat (PET) en polyurethaan. PEG's zijn een familie van polymeren die worden gebruikt in toepassingen zoals: voedselverdikking, constipatiebehandeling, cosmetica, enz..
PET wordt gebruikt bij de productie van allerlei wegwerpverpakkingen, die worden gebruikt in verschillende soorten dranken en voedingsmiddelen. Polyurethaan wordt gebruikt als thermische isolator in koelkasten en als vulstof in verschillende soorten meubels.
Explosieven
Het wordt gebruikt bij de vervaardiging van dynamiet, waardoor het door een verlaging van het vriespunt van nitroglycerine met minder risico kan worden opgeslagen..
Houtbescherming
Ethyleenglycol wordt gebruikt bij de behandeling van hout om het te beschermen tegen rot, geproduceerd door de werking van schimmels. Dit is belangrijk voor het behoud van museumkunstwerken.
Andere apps
Ethyleenglycol is aanwezig in media voor het suspenderen van geleidende zouten in elektrolytische condensatoren en in sojaschuimstabilisatoren. Het wordt ook gebruikt bij de vervaardiging van weekmakers, elastomeren en synthetische wassen.
Ethyleenglycol wordt gebruikt bij de scheiding van aromatische en paraffinische koolwaterstoffen. Bovendien wordt het gebruikt bij de vervaardiging van wasmiddelen voor het reinigen van apparatuur. Verhoogt de viscositeit en vermindert de vluchtigheid van de inkt, waardoor deze gemakkelijker te gebruiken is.
Ook kan ethyleenglycol worden gebruikt in de gieterij van vormzand en als smeermiddel bij het slijpen van glas en cement. Het wordt ook gebruikt als ingrediënt in hydraulische remvloeistoffen en als tussenproduct bij de synthese van esters, ethers, polyestervezels en harsen..
Onder de harsen waarin ethyleenglycol als grondstof wordt gebruikt, is het alkyd, dat wordt gebruikt als basis voor alkydverven, die wordt toegepast in autolakken en bouwverven..
Vergiftiging en risico's
Symptomen bij blootstelling
Ethyleenglycol heeft een lage acute toxiciteit wanneer het inwerkt bij contact met de huid of bij inademing. Maar de toxiciteit ervan komt volledig tot uiting bij inname, aangegeven als de fatale dosis ethyleenglycol van 1,5 g / kg lichaamsgewicht, of 100 ml voor een volwassene van 70 kg..
Acute blootstelling aan ethyleenglycol veroorzaakt de volgende symptomen: inademing veroorzaakt hoesten, duizeligheid en hoofdpijn. Op de huid treedt bij contact met ethyleenglycol droogheid op. Ondertussen veroorzaakt het in de ogen roodheid en pijn.
Schade door inslikken
Inname van ethyleenglycol manifesteert zich door buikpijn, misselijkheid, bewusteloosheid en braken. Een overmatige inname van ethyleenglycol heeft een schadelijk effect op het centrale zenuwstelsel (CZS), de cardiovasculaire functie en de morfologie en fysiologie van de nieren..
Door storingen in het functioneren van het CZS treedt verlamming of onregelmatige oogbeweging (nystagmus) op. In het cardiopulmonale systeem is er hoge bloeddruk, tachycardie en mogelijk hartfalen. Er zijn ernstige veranderingen in de nieren, het product van de vergiftiging met ethyleenglycol.
Dilatatie, degeneratie en afzetting van calciumoxalaat treden op in de niertubuli. Dit laatste wordt verklaard door het volgende mechanisme: ethyleenglycol wordt gemetaboliseerd door het melkzuurdehydrogenase-enzym om glycoaldehyde te produceren.
Glycoaldehyde geeft aanleiding tot glycolzuur, glyoxylzuur en oxaalzuur. Oxaalzuur slaat snel neer met calcium om calciumoxalaat te vormen, waarvan de onoplosbare kristallen worden afgezet in de niertubuli, waardoor morfologische veranderingen en disfunctie daarin ontstaan, wat kan leiden tot nierfalen..
Vanwege de giftigheid van ethyleenglycol is het in sommige van zijn toepassingen geleidelijk vervangen door propyleenglycol.
Ecologische gevolgen van ethyleenglycol
Tijdens het ontdooien geven vliegtuigen aanzienlijke hoeveelheden ethyleenglycol af, die zich ophopen op de landingsbanen, die bij het wassen ervoor zorgen dat het water de ethyleenglycol via het afvoersysteem naar de rivieren afvoert, waar de giftigheid ervan de levensduur van het vliegtuig vissen.
Maar de toxiciteit van ethyleenglycol is op zichzelf niet de belangrijkste oorzaak van ecologische schade. Tijdens de aërobe biologische afbraak wordt een aanzienlijke hoeveelheid zuurstof verbruikt, waardoor het in oppervlaktewater afneemt.
Aan de andere kant kan de anaërobe biologische afbraak giftige stoffen voor vissen vrijgeven, zoals aceetaldehyde, ethanol, acetaat en methaan..
Referenties
- Wikipedia. (2019). Ethyleenglycol. Hersteld van: en.wikipedia.org
- Nationaal centrum voor informatie over biotechnologie. PubChem-database. (2019). 1,2-ethaandiol. CID = 174. Hersteld van: pubchem.ncbi.nlm.nih.gov
- Artem Cheprasov. (2019). Ethyleenglycol: structuur, formule en gebruik. Studie. Hersteld van: study.com
- Leroy G. Wade. (27 november 2018). Ethyleenglycol. Encyclopædia Britannica. Hersteld van: britannica.com
- A. Dominic Fortes en Emmanuelle Suard. (2011). Kristalstructuren van ethyleenglycol en ethyleenglycolmonohydraat. J. Chem. Phys. 135, 234501. doi.org/10.1063/1.3668311
- Icis. (24 december 2010). Ethyleenglycol (EG) Productie- en fabricageproces. Hersteld van: icis.com
- Lucy Bell Young. (2019). Wat zijn de toepassingen van ethyleenglycol? Reagens. Hersteld van: chemicaliën.co.uk
- QuimiNet. (2019). Oorsprong, soorten en toepassingen van ethyleenglycolen. Hersteld van: quiminet.com
- R. Gomes, R. Liteplo en M.E. Zachtmoedig. (2002). Ethyleenglycol: aspecten van de menselijke gezondheid. Wereldgezondheidsorganisatie Genève. [Pdf]. Hersteld van: who.int



Niemand heeft nog op dit artikel gereageerd.