
Aluminiumfosfaat (AlPO4) structuur, eigenschappen, productie, gebruik

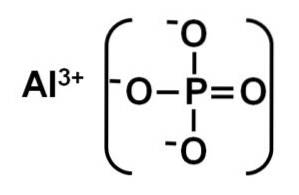
De aluminiumfosfaat is een anorganische vaste stof gevormd door een aluminiumion Al3+ en een fosfaationen PO43-. De chemische formule is AlPO4. Het is een witte vaste stof waarvan de kristallijne structuur vergelijkbaar is met die van silica SiOtwee. Het is onoplosbaar in water.
Het kan worden verkregen uit aluminiumoxide (AltweeOF3) en fosforzuur (H.3PO4Het kan ook worden verkregen uitgaande van waterige oplossingen van aluminiumchloride (AlCl3) en natriumfosfaat (Na3PO4.

Aluminiumfosfaat heeft een zeer hoog smeltpunt en daarom wordt het veel gebruikt als onderdeel van vuurvaste keramiek, dat wil zeggen keramiek dat bestand is tegen zeer hoge temperaturen..
Het wordt ook gebruikt als maagzuurremmer, in mengsels voor het herstel van tanden en als adjuvans bij vaccins, dat wil zeggen om de immuunrespons van het lichaam te stimuleren..
Sommige vuurvaste betonsoorten hebben AlPO4 in zijn samenstelling, die de mechanische en hoge temperatuur ondersteunende eigenschappen van dit type cement verhoogt.
Het is gebruikt als een beschermend schild om te voorkomen dat brandbare materialen, zoals bepaalde polymeren, verbranden.
Artikel index
- 1 Structuur
- 2 Nomenclatuur
- 3 Eigenschappen
- 3.1 Fysieke toestand
- 3.2 Molecuulgewicht
- 3.3 Smeltpunt
- 3.4 Dichtheid
- 3.5 Oplosbaarheid
- 3.6 Overige eigenschappen
- 4 Verkrijgen
- 5 Gebruik in keramiek
- 5.1 Vervaardiging van aluminiumfosfaatkeramiek
- 6 Andere toepassingen
- 6.1 Bij het verkrijgen van beton
- 6.2 In tandcement
- 6.3 In vaccins
- 6.4 Als vlamvertrager in polymeren
- 7 referenties
Structuur
De AlPO4 Het wordt gevormd door een aluminiumkation Al3+ en een fosfaatanion PO43-.
Kristallijn aluminiumfosfaat wordt ook wel berliniet of alfafase (α-AlPO4) en zijn kristallen zijn vergelijkbaar met kwarts.

De alfa-fase van aluminiumfosfaat is een vaste stof die wordt gevormd door een covalent netwerk van PO-tetraëders4 en AlPO4 die wisselen elkaar af en zijn verbonden door zuurstofatomen.
Deze structuur is isomorf met silica, dat wil zeggen, het heeft dezelfde vorm als silica SiOtwee.
Nomenclatuur
- Aluminiumfosfaat
- Aluminium monofosfaat
- Aluminiumzout van fosforzuur.
Eigendommen
Fysieke toestand
Stevig wit kristallijn.
Molecuulgewicht
121,93 g / mol
Smeltpunt
1800 ºC
Dichtheid
2,56 g / cm3
Oplosbaarheid
Onoplosbaar in water
Andere eigenschappen
De structuur van de AlPO4 lijkt sterk op silica SiOtwee, het deelt dus veel fysische en chemische eigenschappen hiervan.
Aluminiumfosfaat is een zeer vuurvast materiaal, dat wil zeggen dat het bestand is tegen zeer hoge temperaturen zonder de fysische toestand of structuur te veranderen en zonder te ontbinden.
De AlPO4 kristallijn of berliniet wordt bij verhitting omgezet in een tridymietachtige structuur en vervolgens cristobaliettype, andere vormen van deze verbinding die lijken op siliciumdioxide SiOtwee.

Het verkrijgen van
Aluminiumfosfaat AlPO4 kan worden verkregen door de reactie tussen fosforzuur H3PO4 en aluminiumoxide AltweeOF3. Temperatuurtoepassing is vereist, bijvoorbeeld tussen 100 en 150 ° C.
Naar detweeOF3 + 2 uur3PO4 = 2 ALPO4 + 3 H.tweeOF
Het kan ook worden verkregen door een waterige oplossing van aluminiumchloride AlCl samen te voegen3 met een waterige oplossing van natriumfosfaat Na3PO4
AlCl3 + Na3PO4 = AlPO4 + 3 NaCl
Gebruik in keramiek
Aluminiumfosfaat AlPO4 wordt vaak aangetroffen in de samenstelling van aluminiumoxide-keramiek.
Keramiek met een hoog aluminiumoxidegehalte is een van de materialen die vanwege zijn hardheid wordt gebruikt in toepassingen waarbij het bestand moet zijn tegen hoge belastingen en zware omstandigheden..
Dit type keramiek is bestand tegen corrosie, omgevingen met hoge temperaturen, de aanwezigheid van hete stoom of reducerende atmosferen zoals koolmonoxide (CO)..
Alumina-keramiek heeft ook een lage elektrische en thermische geleidbaarheid, daarom wordt het gebruikt om vuurvaste stenen en elektrisch isolerende componenten te maken..

Omdat aluminiumfosfaat zich bij een veel lagere temperatuur vormt dan silica SiOtwee, de productie ervan is goedkoper, wat een voordeel is bij de vervaardiging van keramiek dat geschikt is voor veeleisende diensten.
Aluminiumfosfaat keramische productie
Er wordt aluminiumoxide gebruikttweeOF3 en fosforzuur H3PO4 in waterig medium.
De pH van de formatie die de voorkeur heeft is 2-8, aangezien er een overvloed aan opgeloste fosforzuurspecies is, zoals HtweePO4- en HPO4twee-. Bij zure pH de concentratie van Al-ionen3+ is hoog, afkomstig van het oplossen van aluminiumoxide AltweeOF3.
Eerst wordt een gehydrateerde aluminiumdifosfaattriwaterstofgel AlH gevormd.3(PO4twee.H.tweeOF:
Naar de3+ + H.tweePO4- + HPO4twee- + H.tweeO ⇔ AlH3(PO43.H.tweeOF
Er komt echter een tijd dat de pH van de oplossing daalt en neutraal wordt, waar het aluminiumoxide AltweeOF3 het heeft een lage oplosbaarheid. Op dit moment vormt het onoplosbare aluminiumoxide een laag op het oppervlak van de deeltjes, waardoor de reactie niet kan worden voortgezet..
Daarom is het noodzakelijk om de oplosbaarheid van het aluminiumoxide te vergroten en dit wordt bereikt door zachtjes te verwarmen. Bij verwarming tot 150 ° C zet de gel de reactie met aluminiumoxide Al voorttweeOF3 waarbij water en kristallijn berliniet (alfa-AlPO4.
Naar detweeOF3 + 2 AlH3(PO43.H.tweeO → AlPO4 + 4 uurtweeOF
Het berliniet bindt de afzonderlijke deeltjes en vormt het keramiek.
Andere gebruiken
De AlPO4 Het wordt gebruikt als antacidum, als adsorptiemiddel, als moleculaire zeef, als katalysatordrager en als coating om de weerstand tegen hete corrosie te verbeteren. Hieronder andere toepassingen.
Bij het verkrijgen van beton
Aluminiumfosfaat is een ingrediënt in vuurvast beton of hittebestendig beton.
Het biedt uitstekende mechanische en refractieve eigenschappen aan deze betonsoorten, zoals weerstand tegen hitte. In het temperatuurbereik tussen 1400-1600 ° C is cellenbeton op basis van aluminiumfosfaat een van de meest efficiënte materialen als thermische isolator..
Het hoeft niet te worden gedroogd, de verharding wordt bereikt door een zichzelf voortplantende exotherme reactie. Het is mogelijk om stenen van dit materiaal in elke vorm en afmeting te maken.
In tandcement
Aluminiumfosfaat maakt deel uit van tandcement of materialen die worden gebruikt om rotte tanden te genezen.
In tandcement wordt aluminiumoxide gebruikt als moderator van zuur-base-reacties, waarbij het modererende effect het gevolg is van de vorming van aluminiumfosfaat op de deeltjes van andere materialen..
Deze cementen hebben een zeer hoge weerstand tegen compressie en spanning, wat te wijten is aan de aanwezigheid van aluminiumfosfaat.
In vaccins
De AlPO4 Het wordt al vele jaren in verschillende menselijke vaccins gebruikt om de immuunrespons van het lichaam te versterken. Er wordt gezegd dat de AlPO4 het is een "adjuvans" bij vaccins. Het mechanisme is nog steeds niet goed begrepen.
Het is bekend dat het immunostimulerende effect van AlPO4 het hangt af van het adsorptieproces van het antigeen aan het adjuvans, dat wil zeggen van de manier waarop het zich eraan hecht. Een antigeen is een verbinding die bij binnenkomst in het lichaam de vorming van antilichamen genereert om een specifieke ziekte te bestrijden.
Antigenen kunnen worden geadsorbeerd aan AlPO4 door elektrostatische interacties of door binding met liganden. Ze worden geadsorbeerd op het oppervlak van het adjuvans.
Verder wordt aangenomen dat de deeltjesgrootte van AlPO4 het heeft ook invloed. Hoe kleiner de deeltjesgrootte, de antilichaamrespons is groter en duurt langer..
Als vlamvertrager in polymeren
De AlPO4 Het is gebruikt als brandvertrager en om de verbranding of verbranding van bepaalde polymeren te voorkomen.
De toevoeging van AlPO4 aan een polypropyleen polymeer dat al een vlamvertrager heeft veroorzaakt een synergetisch effect tussen beide vertragers, waardoor het effect veel groter is dan dat van beide brandvertragers afzonderlijk.
Wanneer het polymeer wordt verbrand of verbrand in aanwezigheid van AlPO4, er ontstaat een aluminiummetafosfaat dat het verkoolde oppervlak binnendringt en de poriën en scheuren hiervan opvult.
Dit leidt tot de vorming van een zeer efficiënt beschermend schild om verbranding of verbranding van het polymeer te voorkomen. Met andere woorden de AlPO4 dicht het verkoolde oppervlak af en voorkomt dat polymeer verbrandt.

Referenties
- Abyzov, V.A. (2016). Lichtgewicht vuurvast beton op basis van aluminium-magnesiumfosfaatbindmiddel. Procedia Engineering 150 (2016) 1440-1445. Opgehaald van sciencedirect.com.
- Wagh, A.S. (2016). Aluminiumfosfaatkeramiek. In chemisch gebonden fosfaatkeramiek (tweede editie). Hoofdstuk 11. Hersteld van sciencedirect.com.
- Mei, C. et al. (2019). Aluminiumfosfaatvaccin-adjuvans: analyse van samenstelling en grootte met behulp van offline en in-line tools. Comput Struct Biotechnol J. 2019; 17: 1184-1194. Opgehaald van ncbi.nlm.nih.gov.
- Qin, Z. et al. (2019). Synergetisch barrière-effect van aluminiumfosfaat op vlamvertragend polypropyleen op basis van ammoniumpolyfosfaat / dipentaerythritolsysteem. Materials and Design 181 (2019) 107913. Hersteld van sciencedirect.com.
- Vrieling, H. et al. (2019). Gestabiliseerde aluminiumfosfaatnanodeeltjes gebruikt als vaccinadjuvans. Colloïden en oppervlakken B: Biointerfaces 181 (2019) 648-656. Opgehaald van sciencedirect.com.
- Schaefer, C. (2007). Gastro-intestinale medicijnen. Antacida. In geneesmiddelen tijdens zwangerschap en borstvoeding (tweede editie). Opgehaald van sciencedirect.com.
- .


Niemand heeft nog op dit artikel gereageerd.