
Kaliumfosfaat (K3PO4) structuur, eigenschappen, gebruik
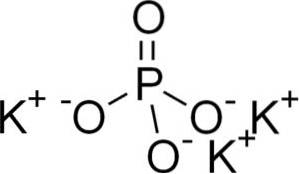
De Kaliumfosfaat is een anorganische verbinding die wordt gevormd door drie kalium-K-ionen+ en een fosfaationen PO43-. De chemische formule is K3PO4. Het is een kleurloze of witte kristallijne vaste stof. Het is zeer oplosbaar in water en vormt alkalische oplossingen, dat wil zeggen met veel OH-ionen-, vandaar basische pH.
Het fosfaation heeft een belangrijke functie in cellen die te maken heeft met energieopslag. Kaliumfosfaat wordt veel gebruikt in organische chemiereacties waar het als basis kan dienen, dat wil zeggen door H-protonen te nemen+. Het kan ook functioneren als katalysator of versneller van sommige reacties.

Het is gebruikt om de aanval van bepaalde insecten op tarweplanten te verminderen, omdat het ze hiertegen resistenter maakt. Er is echter waargenomen dat het de ontwikkeling van methaan (CH4), een broeikasgas, uit rijstmicroculturen.
Het is onder meer gebruikt als laxeermiddel, om de duur van lokale anesthesie te verlengen, gaatjes te stoppen en om oppervlakken te helpen coaten..
Artikel index
- 1 Structuur
- 2 Nomenclatuur
- 3 Eigenschappen
- 3.1 Fysieke toestand
- 3.2 Molecuulgewicht
- 3.3 Smeltpunt
- 3.4 Dichtheid
- 3.5 Oplosbaarheid
- 3,6 pH
- 3.7 Chemische eigenschappen
- 3.8 Overige eigenschappen
- 3.9 Rol van fosfaat in het menselijk lichaam
- 4 Verkrijgen
- 5 toepassingen
- 5.1 Als basis voor organisch-chemische reacties
- 5.2 Als katalysator
- 5.3 In de landbouw
- 5.4 Bij medische toepassingen
- 5.5 Als laxeermiddel
- 5.6 In de diergeneeskunde
- 5.7 Bij het verkrijgen van DNA
- 5.8 In verschillende toepassingen
- 5.9 Negatief aspect voor gebruik in de landbouw
- 6 referenties
Structuur
Kaliumfosfaat bestaat uit drie kalium-K-kationen+ en een fosfaatanion PO43-.
Het fosfaation PO43- Het bestaat uit één fosforatoom (P) en vier zuurstofatomen (O), waarbij fosfor een oxidatietoestand heeft van +5 en zuurstofatomen een valentie van -2.
Nomenclatuur
- Kaliumfosfaat
- Trikaliumfosfaat
- Tribasisch kaliumfosfaat
- Tripotassium orthofosfaat
Eigendommen
Fysieke toestand
Kleurloze of witte kristallijne vaste stof.
Molecuulgewicht
212,27 g / mol
Smeltpunt
1340 ºC
Dichtheid
2564 g / cm3
Oplosbaarheid
Zeer goed oplosbaar in water: 106 g / 100 g water bij 25 ° C. Onoplosbaar in ethanol.
pH
Een oplossing met 1% K3PO4 heeft een pH van 11,5-12,3.
Chemische eigenschappen
Wanneer het wordt opgelost in water, scheidt kaliumfosfaat zich af in de drie kalium K-kationen.+ en het fosfaatanion PO43-. Het fosfaatanion neemt een proton uit het water en het waterstoffosfaatanion HPO wordt gevormd4twee-. De laatste neemt op zijn beurt een ander proton uit het water en wordt het diwaterstoffosfaatanion HtweePO4-.
PO43- + H.tweeO ⇔ HPO4twee- + Oh-
HPO4twee- + H.tweeO ⇔ HtweePO4- + Oh-
Omdat OH-ionen worden gevormd- waterige oplossing wordt alkalisch.
Andere eigenschappen
Naast de watervrije vorm (zonder water), heeft het verschillende gehydrateerde vormen; dit betekent dat het K-molecuul3PO4 kan vergezeld gaan van een of meer watermoleculen binnen de kristallijne structuur.
Om deze reden kan het bijvoorbeeld het monohydraat K vormen3PO4.H.tweeOf, het trihydraat K3PO4.3HtweeOf, het heptahydraat en nonahydraat.
Rol van fosfaat in het menselijk lichaam
Het fosfaation PO43- het is het meest voorkomende anion in cellen en speelt een belangrijke rol bij de opslag van energie.
Het fosfaation neemt ook deel aan de vorming en voedingsactiviteiten van botten en tanden, aangezien het de calciumconcentratie in het bloedserum reguleert en bij talrijke energieoverdrachtsreacties in de cel..
Het verkrijgen van
Kaliumfosfaat kan worden verkregen uit de reactie tussen kaliumchloride KCl en ammoniumfosfaat (NH43PO4.
Kaliumchloride + ammoniumfosfaat → Kaliumfosfaat + ammoniumchloride
3 KCl + (NH43PO4 → K3PO4 + 3 NH4Cl
Toepassingen
Als basis in organische chemiereacties
Kalium K-fosfaat3PO4 Het is gebruikt in verschillende organische chemische reacties. Het dient bijvoorbeeld bij de synthese van acetylenen uitgaande van gedibromeerde verbindingen..
Bij deze synthese vindt een dehydrobromering (eliminatie van waterstof en broom) plaats, waarbij K3PO4 watervrije vaste stof (zonder water) fungeert als een zachte basis en neemt twee protonen uit het molecuul, de twee broomatomen worden verwijderd en het overeenkomstige acetyleen wordt verkregen.
C6H.5-CHBr-CHtweeBr + 2 K3PO4 → C6H.5-C≡CH + 2 KBr + 2 KtweeHPO4

Als katalysator
De K.3PO4 dient als katalysator bij verschillende organische chemiereacties. Het is bijvoorbeeld gebruikt als vaste stof om biodiesel te verkrijgen uit gebruikte frituurolie..
Biodiesel is een brandstof die lijkt op diesel, maar wordt verkregen uit al dan niet gebruikte vetten of natuurlijke oliën.
Kaliumfosfaat was effectiever als katalysator of versneller van deze reactie dan natriumfosfaat Na3PO4 en calciumoxide CaO.
In de landbouw
De K.3PO4 is gebruikt om tarweplanten te behandelen en ze resistent te maken tegen bepaalde plagen.

Sommige onderzoekers behandelden tarwezaailingen met kaliumfosfaat en het bleek dat het resistentie tegen bladluizen induceert. Diuraphis noxia, een insect dat deze planten aanvalt.
Na het aanbrengen van een verdunde oplossing van K3PO4 bij de zaailingen werd minder ernst van de symptomen waargenomen die door deze insecten werden veroorzaakt en een afname van het aantal bladluizen dat zich ermee voedde.

In medische toepassingen
Kaliumfosfaat is gebruikt om het anesthetische effect van lidocaïne, een lokaal anestheticum, te wijzigen. Een lokaal anestheticum is een medicijn dat, wanneer het op een deel van het lichaam wordt aangebracht, de gevoeligheid voor pijn in dat gebied vermindert..
Het bleek dat de K3PO4 maakt het mogelijk om de lokale anesthesie van lidocaïne te verlengen.
Als laxeermiddel
Kaliumfosfaat verhoogt de vloeibaarheid van de darminhoud omdat het helpt om water in de darm vast te houden, wat indirect de samentrekking van de darmspier induceert.
In diergeneeskunde
De K.3PO4 wordt gebruikt bij dieren met diabetische ketoacidose (een complicatie van diabetes) om hypofosfatemie (lage hoeveelheid fosfaat in het bloed) te behandelen.
Bij overmatige toediening kan het echter hypocalciëmie (laag calciumgehalte in het bloed), hyperfosfatemie (te veel fosfaat in het bloed), onvrijwillige samentrekking van spieren, mineralisatie van zachte weefsels en nierfalen veroorzaken..
Bij het verkrijgen van DNA
Kaliumfosfaat is gebruikt als buffer om DNA te zuiveren in genetica-laboratoria.
DNA is een eiwit dat in cellen wordt aangetroffen en dat alle genetische informatie bevat die nodig is voor de ontwikkeling en het functioneren van levende wezens..
Door DNA te isoleren, verdiepen wetenschappers zich in de studie van hoe erfelijke eigenschappen worden overgedragen, daarom is kaliumfosfaat erg nuttig.
In verschillende toepassingen
Kalium K-fosfaat3PO4 het dient:
- als een dieet supplement,
- voor vervanging van elektrolyt,
- als buffer, dat wil zeggen als een chemisch systeem waarmee de niveaus van OH-ionen kunnen worden geregeld- of waterstof H+ in waterige oplossing,
- om tandbederf te vertragen of te remmen,
- als corrosieremmer en antifouling-middel,
- als middel voor oppervlaktebehandeling en als bekledingsmiddel,
- als antivries,
- in schoonmaakproducten.

Negatief aspect voor gebruik in de landbouw
Bepaalde onderzoekers ontdekten dat het toevoegen van K3PO4 een microcultuur van rijst verhoogt de uitstoot van methaan (CH4) naar de atmosfeer. Methaan is een gas dat bijdraagt aan het broeikaseffect en de temperatuur van onze planeet verhoogt.
Referenties
- ONS. Nationale bibliotheek van geneeskunde. (2019). Kaliumfosfaat. Opgehaald van pubchem.ncbi.nlm.nih.gov.
- Panciera, D.L. (2012). Vloeistoftherapie bij endocriene en stofwisselingsstoornissen. Fosfor-suppletie. In vloeistof-, elektrolyt- en zuur-base-aandoeningen in de praktijk van kleine dieren (vierde editie). Opgehaald van sciencedirect.com.
- Shenawi-Khalil, S. et al. (2012). Synthese van acetylenen via dehydrobromering met behulp van vast watervrij kaliumfosfaat als basis onder faseoverdrachtscondities. Tetrahedron Letters, Volume 53, Issue 18, 2012, Pages 2295-2297. Opgehaald van sciencedirect.com.
- Guan, G. et al .; (2009). Trikaliumfosfaat als vaste katalysator voor de productie van biodiesel uit afgewerkte bakolie. Fuel Processing Technology, jaargang 90, nummer 4, 2009, pagina's 520-524. Opgehaald van sciencedirect.com.
- Kulkami, M.A. (2012). Mechanistische benadering voor snelle en oplosmiddelvrije synthese van α-hydroxyfosfonaten met kaliumfosfaat als katalysator. Komt uit Rendus Chimie, Vol 16, Issue 2, 2013, Pages 148-152. Opgehaald van sciencedirect.com.
- Venter, E. et al. (2014). Kaliumfosfaat wekt tolerantie op tegen de Russische tarwebladluis (Diuraphis noxia, Homoptera: Aphididae) in tarwe. Crop Protection Vol 61, juli 2014, pagina's 43-50. Opgehaald van sciencedirect.com.
- Bonturi, N. et al. (2013). Natriumcitraat en kaliumfosfaat als alternatieve adsorptiebuffers bij hydrofobe en aromatische thiofiele chromatografische zuivering van plasmide-DNA uit geneutraliseerd lysaat. Journal of Chromatography B, Volumes 919-920, 2013, pagina's 67-74. Opgehaald van sciencedirect.com.
- Conrad, R. en Klose, M. (2005). Effect van kaliumfosfaatbemesting op productie en uitstoot van methaan en methaan 13C-stabiele isotopensamenstelling in de microkosmos van rijst. Bodembiologie en biochemie, deel 37, nummer 11, 2005, pagina's 2099-2108. Opgehaald van sciencedirect.com.
- Lide, D.R. (redacteur) (2003). CRC Handbook of Chemistry and Physics. 85th CRC Press.
- Rookvoet. (2019). Trikaliumfosfaat. Opgehaald van en.wikipedia.org


Niemand heeft nog op dit artikel gereageerd.