
Structuurformule (met voorbeelden)
De structurele Formule het is een grafische weergave van de bindingen van een molecuul, die licht werpt op de structuur ervan zodra deze is bepaald door spectroscopische methoden. Het is de meest specifieke manier om naar een specifieke verbinding te verwijzen, en niet naar verschillende isomeren die overeenkomen met dezelfde molecuulformule.
Bijvoorbeeld butaan, C4H.10, heeft twee isomeren: n-butaan (lineair) en 2-methylpropaan (vertakt). De molecuulformule maakt geen onderscheid tussen beide; terwijl als we onze toevlucht nemen tot structurele formules, we precies zullen zien dat de ene lineair is en de andere vertakt.
Door structurele formules te gebruiken, wordt het gemakkelijker om de veranderingen te begrijpen die een molecuul ondergaat tijdens een chemische reactie; welke van de schakels zijn verbroken, hoe de structuur wordt gewijzigd in het proces en aan het einde ervan. Deze formules leren lezen is hetzelfde als oppervlakkig de eigenschappen van moleculen voorspellen.
Structuurformules zijn 2D-weergaven, hoewel ze enkele driedimensionale en geometrische aspecten kunnen aangeven. Hoe meer de structuur van een verbinding wordt onderzocht, hoe verfijnder en getrouwer de structuurformule wordt. Anders laat het essentiële aspecten weg om de aard van het molecuul te begrijpen.
Artikel index
- 1 Voorbeelden van structuurformules
- 1.1 Glucose
- 1.2 Methaan
- 1,3 Methanol
- 1.4 Ethanol
- 1.5 Fructose
- 1.6 Water
- 1.7 Aspirine
- 1.8 Benzeen
- 2 referenties
Voorbeelden van structuurformules
Elke verbinding heeft zijn respectievelijke structuurformule, die kan variëren afhankelijk van het type projectie of perspectief dat wordt gebruikt. Gecondenseerde formules en skeletformules, Lewis-structuren en stereochemische projecties zijn bijvoorbeeld allemaal structurele formules, bedoeld om zoveel mogelijk informatie over de moleculaire structuur in een grafiek weer te geven..
Het zijn er zo veel dat er maar een paar eenvoudige voorbeelden aan bod komen..
Glucose

Vier afbeeldingen van het glucosemolecuul worden weergegeven in de bovenste afbeelding. Elk is een geldige structuurformule; maar 2 (Haworth-projectie) en 3 (stoelprojectie) worden meestal het meest gebruikt in academische teksten en in publicaties.
De 4 heeft als voordeel dat het direct aangeeft welke OH-groepen boven (dikke wiggen) of onder (gestippelde wiggen) de zeshoekige ring zitten; dat wil zeggen, het vergemakkelijkt het begrip van zijn stereochemie. Daarentegen toont de 1 (Tollens-Fisher-projectie) het lineaire karakter van glucose voordat het wordt omgezet in zijn cyclische vorm.
Methaan
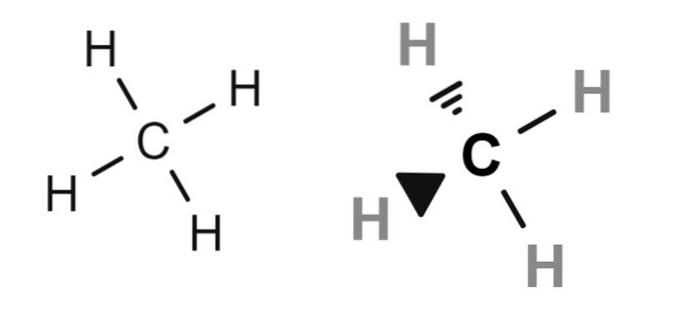
Hierboven staan twee structuurformules van methaan, waarvan de gecondenseerde molecuulformule CH is4. Voor degenen die geen kennis hebben van scheikunde, kunnen ze de formule CH interpreteren4 alsof het een molecuul is met een waterstofatoom in het midden.
Maar in werkelijkheid (en noodzakelijkerwijs) maken de structuurformules duidelijk dat koolstof het centrale atoom is. Daarom hebben we vier C-H-bindingen. Merk ook op dat de formule aan de linkerkant de verkeerde indruk wekt dat het molecuul plat is, terwijl het in werkelijkheid tetraëdrisch is (formule aan de rechterkant).
Daarom worden in de structuurformule hiernaast de bindingen weergegeven door wiggen, die de relatieve ruimtelijke posities van elk waterstofatoom aangeven (hoekpunten van de tetraëder).
Methanol

De structuurformule van methanol is nagenoeg gelijk aan die van methaan, met het verschil dat er een H is gesubstitueerd door een OH. De gecondenseerde of chemische formule is CH3OH, en de moleculaire CH4O. Opgemerkt wordt dat het ook uit een tetraëder bestaat.
Ethanol
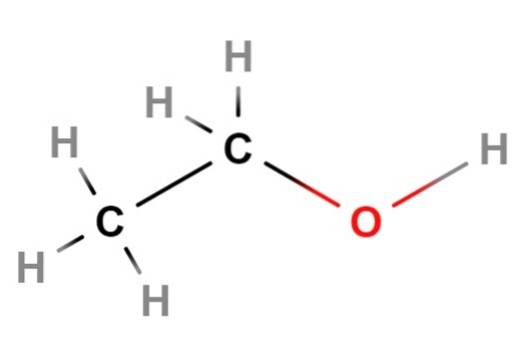
Nu gaan we verder met ethanol, de volgende alcohol op de lijst. De chemische of gecondenseerde formule is CH3CHtweeOH, dat op zichzelf al zijn lineaire structuur laat zien. Zeker, de structuurformule in de afbeelding hierboven toont effectief aan dat ethanol een lineaire ketting of skelet is..
Als je goed kijkt, is de omgeving van elk koolstofatoom tetraëdrisch.
Fructose

Hierboven hebben we de structuurformule van fructose, meer bepaald de Haworth-projectie van zijn furanusring (vijfledig). Merk op hoeveel de structuurformule onthult in tegenstelling tot de moleculaire formule, C6H.12OF6, die samenvalt met die van glucose, maar beide zijn echter verschillende suikers.
Water

De chemische formule van water is H.tweeOf, corresponderend ook met de gecondenseerde en moleculaire formules. Net als bij methaan kunnen degenen die het watermolecuul niet kennen (en geen idee hebben van chemische bindingen) geloven dat de structuur O-H-H is; maar de structuurformule in de afbeelding hierboven verduidelijkt de ware structuur.
Hoewel het niet wordt ingezien, trekken de paren vrije elektronen van zuurstof en waterstofatomen een tetraëder rond de zuurstof; dit is de elektronische geometrie van water: tetraëdrische. Ondertussen vormen de twee waterstofatomen een vlak dat lijkt op een boemerang; dit is de moleculaire geometrie van water: hoekig.
Hoewel de structuurformule van water verreweg de eenvoudigste van de besproken voorbeelden is, verbergt het meer geheimen en anomalieën dan het alleen kan vertegenwoordigen..
Aspirine
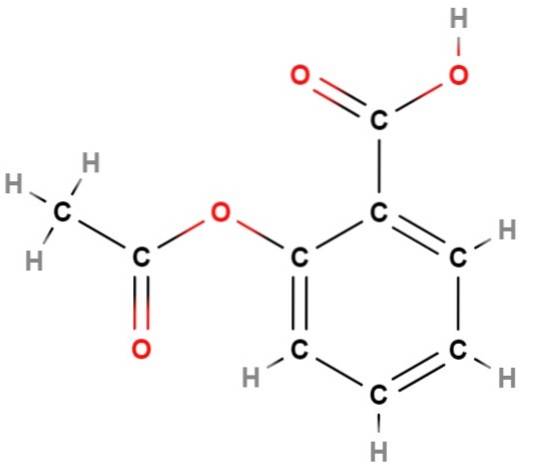
We hebben een van de eerste "mislukkingen" van structuurformules: hun onvermogen om het aromatische karakter van een structuur weer te geven; die in dit geval overeenkomt met de aromaticiteit van de benzeen (hexagonale) ring van aspirine (hierboven).
Als je deze formule zorgvuldig bekijkt, zul je concluderen dat het een in wezen plat molecuul is; dat wil zeggen, bijna al zijn atomen "rusten" in hetzelfde vlak, met uitzondering van de methylgroep, CH3, aan de linkerkant, waar de tetraëdrische omgeving van koolstof opnieuw wordt gevisualiseerd.
Nogmaals, de structuurformule geeft veel meer informatie dan de gewone molecuulformule, C9H.8OF4wat overeenkomt met talrijke structurele isomeren, totaal verschillend van aspirine.
Benzeen
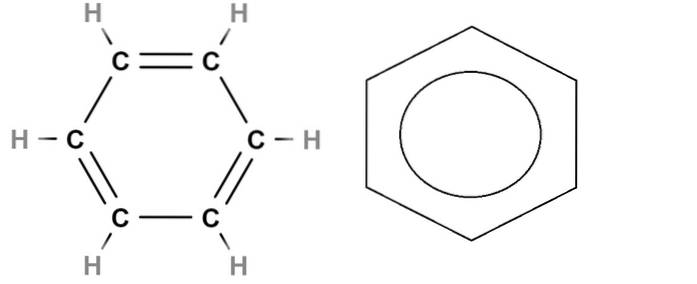
Om te eindigen hebben we hierboven de structuurformule van benzeen. De moleculaire formule is C6H.6, wat aangeeft dat het zes koolstofatomen en zes waterstofatomen bevat. Maar het zegt niets over de ware structuur van benzeen.
De C = C dubbele bindingen zijn niet statisch, aangezien een paar elektronen, met name degene die zich in de orbitalen bevindt p van koolstof, wordt het binnen de ring gedelokaliseerd. Benzeen heeft daardoor meerdere resonantiestructuren, elk met zijn eigen structuurformule..
Deze delokalisatie maakt deel uit van het aromatische karakter van benzeen, niet getrouw weergegeven in de structuurformule aan de linkerkant. Het dichtst is om de dubbele bindingen te vervangen door een cirkel (door sommigen een donut genoemd) om de aromaticiteit van de ring aan te geven (rechts van de afbeelding).
En hoe zit het met de skeletformule? Dit lijkt erg op de structurele, maar verschilt alleen doordat het geen waterstofatomen vertegenwoordigt; en daarom is het eenvoudiger en comfortabeler om grafieken te maken. De benzeenring aan de rechterkant zou de skeletformule zijn.
Referenties
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8e ed.). CENGAGE Leren.
- Wikipedia. (2020). Structurele Formule. Hersteld van: en.wikipedia.org
- Nissa Garcia. (2020). Structuurformule: definitie en voorbeelden. Studie. Hersteld van: study.com
- Clark Jim. (2012). Organische moleculen tekenen. Hersteld van: chemguide.co.uk
- William Reusch. (5 mei 2013). De vorm van moleculen. Hersteld van: 2. chemistry.msu.edu



Niemand heeft nog op dit artikel gereageerd.