
Minimale formule om de minimale formule, voorbeelden en oefeningen te krijgen
De minimale of empirische formule Het is een uitdrukking van de verhouding waarin de atomen van de verschillende elementen waaruit een chemische verbinding bestaat, aanwezig zijn. De minimumformule is dus de eenvoudigste weergave van een chemische verbinding. Dit is waarom het 'minimaal' is.
De minimumformule geeft niet het aantal atomen weer van de verschillende elementen waaruit een chemische verbinding bestaat; maar de verhouding waarin deze atomen zich verenigen om de chemische verbinding te genereren.
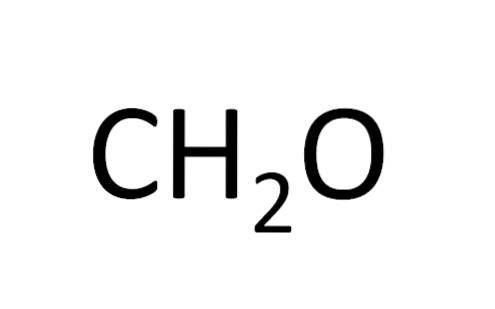
De minimumformule wordt ook wel de empirische formule genoemd, aangezien deze wordt verkregen door experimenten; dat wil zeggen, het is gerelateerd aan ervaring. Experimentele waarneming liet toe om te concluderen dat twee waterstofatomen combineren met één waterstofatoom om water te vormen (H.tweeOF).
In veel gevallen komt de minimumformule overeen met de molecuulformule. In het molecuul verschijnen de werkelijke aantallen van de verschillende elementen waaruit een chemische verbinding bestaat; dat is bijvoorbeeld het geval met zwavelzuur (H.tweeSW4.
Maar in andere gevallen is er geen samenloop van de minimumformule en de molecuulformule; Dat is het geval bij benzeen: de minimumformule is CH, terwijl de molecuulformule C is6H.6.
Artikel index
- 1 Hoe de minimumformule te verkrijgen?
- 1.1 Eerste stap
- 1.2 Tweede stap
- 1.3 Derde stap
- 1.4 Vierde stap
- 2 Voorbeelden van minimumformules
- 2.1 Water en kooldioxide
- 2.2 Basische en zure oxiden
- 2.3 Azijnzuur
- 2.4 Boterzuur
- 2.5 Ethyleenglycol
- 2.6 Benzeen
- 2.7 Glucose
- 3 Opgeloste oefeningen
- 3.1 - Oefening 1
- 3.2 - Oefening 2
- 4 referenties
Hoe de minimale formule te krijgen?
Eerste stap
Zoek de grammen van elk element dat in de compound aanwezig is. Omdat ze meestal worden uitgedrukt als een percentage van de massa van de verbinding, moet een eenvoudige berekening worden gemaakt voor de omzetting van de massapercentages in massa van de elementen..
Tweede stap
Het relatieve aantal atomen van de verschillende elementen waaruit de chemische verbinding bestaat, wordt verkregen. Om dit te doen, wordt de massa van elk element, uitgedrukt in gram, gedeeld door zijn atomaire massa.
Sommige auteurs geven er de voorkeur aan om het relatieve aantal atomen te noemen, omdat het aantal mol atomen van de elementen die deel uitmaken van de chemische verbinding.
Derde stap
Het minimale aandeel, uitgedrukt in hele getallen, verkrijgen van elk van de atomen die in de chemische verbinding aanwezig zijn.
Om deze waarden te vinden, deelt u de relatieve getallen van elk atoom dat aanwezig is in de verbinding door de minimale relatieve numerieke waarde die een atoom heeft in de chemische verbinding..
In het geval dat de waarde van het minimum aandeel van een atoom geen geheel getal is zonder decimalen, moeten alle waarden van het minimum aandeel worden vermenigvuldigd met een getal; op zo'n manier dat alle waarden van de minimale proportie hele getallen zijn.
Als de waarde van het minimumaandeel van een atoom van de chemische verbinding bijvoorbeeld 2,5 is, vermenigvuldig dan iedereen de waarden van de minimale proportie van elk van de atomen aanwezig maal 2. Alle waarden van de minimale proportie zijn dus alleen hele getallen.
Vierde stap
Schrijf de minimumformule van de verbinding. De waarden van de minimumverhouding voor de atomen van de verschillende elementen worden geplaatst als subscripts van de chemische symbolen van elementen om de minimumformule te schrijven.
Minimale formulevoorbeelden
Water en kooldioxide
De meeste chemische verbindingen hebben formules die zowel minimale als moleculaire formules zijn. Zo is de formule voor water (H.tweeO) is een minimale formule; maar het is ook een moleculaire formule. Hetzelfde geldt voor de formule voor kooldioxide (COtwee.
Basische en zure oxiden
Basische en zuuroxiden zijn chemische verbindingen met chemische formules, op enkele uitzonderingen na die zowel minimale als moleculaire formules zijn. Dezelfde situatie doet zich voor met hydroxiden en zuren, met uitzondering van enkele carbonzuren..
Azijnzuur
Carbonzuren met een even aantal koolstofatomen in hun samenstelling hebben afzonderlijk een minimumformule en een molecuulformule. Azijnzuur heeft bijvoorbeeld een molecuulformule (C.tweeH.4OFtweemaar het heeft ook een minimale formule (CHtweeOF).
Boterzuur
Boterzuur heeft ook een molecuulformule (C.4H.8OFtwee) en een minimale formule (CtweeH.4OF).
Ethyleenglycol
Andere organische verbindingen hebben beide soorten chemische formules; dat is het geval met ethyleenglycol, dat een molecuulformule heeft (C.tweeH.6OFtwee) en een minimale formule (CH3OF).
Benzeen
Benzeen, een aromatische verbinding, heeft een molecuulformule (C.6H.6) en een minimale formule (CH).
Glucose
Glucose heeft een moleculaire formule (C.6H.12OF6) en een minimale formule (CHtweeOF).
Opgeloste oefeningen
- Oefening 1
Ethyleenglycol is een verbinding die als antivriesmiddel wordt gebruikt, het heeft een molecuulgewicht van 62,1 g / mol en een massapercentage als volgt:
C: 38%,
H: 9,7%
Of: 51,16%.
Eerste stap
Druk de massapercentages van de elementen in hun massa in grammen uit. Hiervoor wordt het molecuulgewicht van ethyleenglycol als referentie genomen. Als dit 62,1 gram per mol is, bestaat 38% daarvan uit koolstof. En zo verder met de andere elementen:
Koolstofmassa = 62,1 g (38/100)
= 23,6 g
Massa waterstof = 62,1 g (9,7 / 100)
= 6,024 g
Massa zuurstof = 62,1 g (51,16 / 100)
= 31,77 g
Tweede stap
Bereken het relatieve aantal van elk aanwezig atoom (NRA) of het aantal mol van elk atoom. Om dit te doen, wordt de massa van elk chemisch element gedeeld door zijn atomaire massa.
NRA (C) = 23,6 g / 12 g
= 1,97
Kan worden afgerond op 2.
NRA (H) = 6,024 g / 1 g
= 6,024
Kan worden afgerond op 6.
NRA (O) = 31,77 g / 16 g
= 1.985
Kan worden afgerond op 2.
Derde stap
Bereken de minimale gehele verhouding van de elementen van de verbinding (PMNE). Om dit te doen, deelt u elk van de waarden van de atomaire relatieve getallen (NRA) door de kleinste waarde hiervan. In dit geval 2.
PMNE (C) = 2/2
= 1
PMNE (H) = 6/2
= 3
PMNE (O) = 2/2
= 1
Vierde stap
Schrijf de minimumformule voor ethyleenglycol:
CH3OF
Zoals te zien is, zijn de waarden die zijn verkregen in stap 3 de subscripts van de elementen van de verbinding.
- Oefening 2
Azijnzuur heeft een molecuulgewicht van 60 g / mol en de volgende massapercentagesamenstelling:
C: 40%
H: 6,67%
Of: 53,33%
Verkrijg de minimale formule van de verbinding.
Eerste stap
Transformeer de massapercentages van de elementen in hun massa's uitgedrukt in grammen:
Koolstofmassa = 60 g (40/100)
= 24 g
Massa waterstof = 60 g (6,67 / 100)
= 4 g
Massa zuurstof = 60 g (53.33 / 100)
= 32 g
Tweede stap
Bereken het relatieve aantal atomen (NRA) van de verbinding. Om dit te doen, worden de massa's van de elementen gedeeld door hun atomaire massa:
NR (C) = 24 g / 12 g
= 2
NR (H) = 4 g / 1 g
= 4
NR (O) = 32 g / 16 g
= 2
Derde stap
Verkrijg de minimale verhouding van het gehele getal van de elementen van de verbinding (PMNE). Om dit te doen, worden de NRI-waarden van de elementen gedeeld door de laagste NRI-waarde die een element heeft:
PMNE (C) = 2/2
= 1
PMNE (H) = 4/2
= 2
PMNE (O) = 2/2
= 1
Vierde stap
Schrijf de minimumformule voor azijnzuur:
CHtweeOF
De subscripts van de verbinding zijn de waarden die zijn verkregen van PMNE.
Referenties
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8e ed.). CENGAGE Leren.
- Helmenstine, Anne Marie, Ph.D. (27 augustus 2019). Empirische formule: definitie en voorbeelden. Hersteld van: thoughtco.com
- Wikipedia. (2020). Empirische formule. Hersteld van: en.wikipedia.org
- Chemie LibreTexts. (3 juli 2019). Empirische formules voor verbindingen berekenen. Hersteld van: chem.libretexts.org
- Nicola McDougal. (2020). Empirische formule: definitie, stappen en voorbeelden. Studie. Hersteld van: study.com



Niemand heeft nog op dit artikel gereageerd.