
Fosfor geschiedenis, eigenschappen, structuur, verkrijgen, gebruik
De bij elkaar passen Het is een niet-metallisch element dat wordt weergegeven door het chemische symbool P en atoomnummer 15 heeft. Het heeft drie allotrope hoofdvormen: witte, rode en zwarte fosfor. Witte fosfor is fosforescerend, brandt spontaan bij blootstelling aan lucht en is ook zeer giftig..
Witte fosfor wordt bij een temperatuur van 250 ºC rode fosfor; een onoplosbare, polymere vorm die niet in lucht verbrandt. Bij hoge temperaturen en drukken, al dan niet in aanwezigheid van katalysatoren, wordt zwarte fosfor verkregen, dat lijkt op grafiet en een goede geleider van elektriciteit is..

Fosfor werd voor het eerst geïsoleerd door H. Brand in 1669. Hiervoor gebruikte hij urine als bron van dit element. In 1770 ontdekte W. Scheele dat hij ook fosfor uit botten kon isoleren.
Later, dankzij de oprichting van de elektrische oven door J. Burgess Readman (1800), werden fosfaatgesteenten de belangrijkste bron van fosforproductie uit het mineraal fluorapatiet dat erin aanwezig is..
Fosfor is het twaalfde meest voorkomende element in de aardkorst, goed voor 0,1% van het gewicht. Bovendien is het het zesde element in overvloed in het menselijk lichaam; voornamelijk geconcentreerd in botten in de vorm van hydroxylapatiet.
Het is daarom een essentieel element voor levende wezens en wordt een van de drie belangrijkste voedingsstoffen van planten. Fosfor maakt deel uit van de chemische structuur van nucleïnezuren; van energieopslagverbindingen (ATP), co-enzymen; en in het algemeen van verbindingen van het metabolisme.
Artikel index
- 1 Geschiedenis
- 1.1 - Ontdekking
- 1.2 - Industriële ontwikkeling
- 2 Fysische en chemische eigenschappen
- 2.1 Uiterlijk
- 2.2 Atoomgewicht
- 2.3 Atoomnummer (Z)
- 2.4 Smeltpunt
- 2.5 Kookpunt
- 2.6 Dichtheid (kamertemperatuur)
- 2.7 Warmte van fusie
- 2.8 Verdampingswarmte
- 2,9 Molaire warmtecapaciteit
- 2.10 oxidatietoestanden
- 2.11 Elektronegativiteit
- 2.12 Ionisatie-energie
- 2.13 Thermische geleidbaarheid
- 2.14 Magnetische volgorde
- 2.15 Isotopen
- 2.16 Fosforescentie
- 2.17 Allotrope veranderingen
- 2.18 Oplosbaarheid
- 2.19 Reactiviteit
- 3 Structuur en elektronische configuratie
- 3.1 - Links en tetraëdrische eenheid
- 3.2 - Allotropen
- 4 Waar te vinden en te verkrijgen
- 4.1 Apatiet en fosforiet
- 4.2 Elektrothermische reductie van fluorapatiet
- 5 legeringen
- 5.1 Koper
- 5.2 Brons
- 5.3 Vernikkeld
- 6 Risico's
- 7 toepassingen
- 7.1 - Elementair fosfor
- 7.2 - Verbindingen
- 8 referenties
Verhaal
- Ontdekking
In de urine

Fosfor werd in 1669 door Henning Brand geïsoleerd, de eerste mens die een element isoleerde. Brand was een Duitse alchemist uit Hamburg en wist een fosforverbinding uit urine te halen. Om dit te doen, verzamelde hij de urine uit 50 emmers en liet deze ontbinden.
Brand verdampte vervolgens de urine en kreeg een zwartachtig residu, dat hij enkele maanden bewaarde. Hieraan voegde hij zand toe en verwarmde het, en slaagde erin gassen en oliën te verwijderen. Ten slotte verkreeg hij een witte vaste stof die in het donker gloeide met een groene kleur, die hij "koud vuur" noemde..
De term 'fosfor' komt toevallig van het Griekse woord 'fosfor' dat drager van licht betekent..
Brand publiceerde zijn experimentele resultaten niet en verkocht het aan verschillende alchemisten, waaronder: Johann Kraft, Kunckel Lowenstern en Wilhelm Leibniz. Waarschijnlijk hebben sommigen van hen het werk van Brand gerapporteerd aan de Academie van Wetenschappen van Parijs, waardoor hun onderzoek werd verspreid.
Brand isoleerde echter niet echt fosfor, maar ammoniak-natriumfosfaat [Na (NH4) PO4In 1680 verbeterde Robert Boyle de procedure van Brand, waardoor hij een allotrope vorm van fosfor (P4.
In de botten
Johan Gottlieb Gahn en Carl Wihelm Scheele stelden in 1769 vast dat een fosforverbinding, calciumfosfaat, in botten werd aangetroffen. De ontvette botten werden onderworpen aan een verteringsproces met sterke zuren, zoals zwavelzuur.
Vervolgens werd het vergistingsproduct verhit in stalen containers met steenkool en steenkool, waardoor witte fosfor werd verkregen door destillatie in retorten. Botten waren de belangrijkste bron van fosfor tot 1840, toen ze voor dit doel werden vervangen door guano..
In de guano
Guano is een mengsel van vogelpoep en afbraakproducten voor vogels. Het werd in de 19e eeuw gebruikt als bron van fosfor en meststoffen.
- Industriële ontwikkeling
Fosfaatgesteenten werden in 1850 gebruikt als bron van fosfor. Dit, samen met de uitvinding van de elektrische oven voor het calcineren van gesteente door James Burgess Readman (1888), maakte fosfaatgesteente tot de belangrijkste grondstof voor de productie van fosfor en kunstmest..
In 1819 werden de lucifersfabrieken opgericht, waarmee de industriële ontwikkeling van het gebruik van fosfor begon..
Fysische en chemische eigenschappen
Uiterlijk
Afhankelijk van de allotrope vorm kan deze kleurloos, wasachtig wit, geel, scharlakenrood, rood, paars of zwart zijn.
Atoomgewicht
30.973 u
Atoomnummer (Z)
vijftien
Smeltpunt
Witte fosfor: 44,15 ºC
Rode fosfor: ~ 590 ºC
Kookpunt
Witte fosfor: 280,5 ºC
Dichtheid (kamertemperatuur)
Wit: 1.823 g / cm3
Rood: 2,2-2,34 g / cm3
Violet: 2,36 g / cm3
Zwart: 2,69 g / cm3
Warmte van fusie
Witte fosfor: 0,66 kJ / mol
Warmte van verdamping
Witte fosfor: 51,9 kJ / mol
Molaire warmtecapaciteit
Witte fosfor: 23.824 J / (mol.K)
Oxidatietoestanden
-3, -2, -1, +1, +2, +3, +4 en +5
Afhankelijk van de elektronegativiteit van de elementen waarmee het combineert, kan fosfor de oxidatietoestand +3 of -3 vertonen. Fosfor heeft, in tegenstelling tot stikstof, de neiging om bij voorkeur te reageren met de oxidatietoestand +5; dat is het geval met fosforpentoxide (P.tweeOF5 of Ptwee5+OF5twee+.
Elektronegativiteit
2.19 op de schaal van Pauling
Ionisatieenergie
-Ten eerste: 1.101 kJ / mol
-Ten tweede: 2.190,7 kJ / mol
-Ten derde: 2.914 kJ / mol
Warmtegeleiding
Witte fosfor: 0,236 W / (mK)
Zwarte fosfor: 12,1 W / (mK)
Het laat zien hoe zwarte fosfor bijna zes keer meer warmte geleidt dan witte fosfor.
Magnetische volgorde
Witte, rode, paarse en zwarte fosforen zijn diamagnetisch.
Isotopen
Fosfor heeft 20 isotopen, waarvan de belangrijkste zijn: 31P, de enige stabiele isotoop met een overvloed van 100%; 32P, β-emitterende isotoop- en met een halfwaardetijd van 14,28 dagen; Y 33P, een β-emitterende isotoop- en met een halfwaardetijd van 25,3 dagen.
Fosforescentie
Witte fosfor is fosforescerend en geeft in het donker groen licht.
Allotrope veranderingen
Witte fosfor is onstabiel en verandert bij temperaturen in de buurt van 250 ° C in een polymere vorm die bekend staat als rode fosfor, die kan variëren van oranje tot paars van kleur. Het is een amorfe substantie, maar het kan kristallijn worden; gloeit niet in het donker en brandt niet in de lucht.
Witte fosfor verandert bij hoge temperaturen en drukken of in aanwezigheid van katalysatoren in een andere polymere vorm dan rode fosfor: zwarte fosfor. Dit is een kristallijne substantie met een zwarte kleur, inert, vergelijkbaar met grafiet, en die het vermogen heeft om elektriciteit te geleiden.
Oplosbaarheid
Witte fosfor in zuivere vorm is onoplosbaar in water, hoewel het kan worden opgelost in koolstofsulfide. Ondertussen zijn rode en zwarte fosfor onoplosbaar in water en minder vluchtig dan witte fosfor..
Reactiviteit
Fosfor brandt spontaan in lucht om P te vormentweeOF5, en dit kan op zijn beurt reageren met drie moleculen water om orthofosforzuur of fosforzuur te vormen (H.3PO4.
Door de werking van heet water, fosfine (PH3) en fosforoxzuren.
Fosforzuur werkt in op fosfaatgesteenten en veroorzaakt diwaterstofcalciumfosfaat of superfosfaat [Ca (HtweePO4twee.
Kan reageren met halogenen om halogeniden PX te vormen3, X staat voor F, Cl, Br of I; of halogeniden met formule PX5, waarbij X de F, Cl of Br is.
Ook reageert fosfor met metalen en metalloïden om fosfiden te vormen, en met zwavel om verschillende sulfiden te vormen. Aan de andere kant bindt het zich aan zuurstof om esters te maken. Op dezelfde manier combineert het met koolstof om organische fosforverbindingen te vormen..
Structuur en elektronische configuratie
- Obligaties en tetraëdrische eenheid
Fosforatomen hebben de volgende elektronische configuratie:
[Ne] 3stwee 3p3
Het heeft daarom vijf valentie-elektronen, zoals stikstof en de andere elementen van groep 15. Omdat het een niet-metallisch element is, moeten de atomen covalente bindingen vormen totdat het valentie-octet is voltooid. Stikstof bereikt dit door zichzelf te vestigen als twee atomen moleculen Ntwee, met een drievoudige binding, N≡N.
Hetzelfde gebeurt met fosfor: twee van zijn P-atomen binden zich met een drievoudige binding om het P-molecuul te vormentwee, P≡P; dat wil zeggen, de difosforallotroop. Fosfor heeft echter een hogere atomaire massa dan stikstof, en zijn 3p-orbitalen, diffuser dan die van stikstof 2p, overlappen elkaar minder efficiënt; daarom is de Ptwee bestaat alleen in gasvormige toestand.
In plaats daarvan geven de P-atomen er bij kamertemperatuur de voorkeur aan zich covalent op een andere manier te organiseren: in een tetraëdrische molecuul P4

Merk op dat in de bovenste afbeelding alle P-atomen drie enkele bindingen hebben in plaats van één drievoudige binding. Dus de fosfor in P4 voltooit zijn valentie-octet. In de P4 er is spanning in de P-P-bindingen, aangezien hun hoeken verre van 109,5 ° zijn met het blote oog.
- Allotropen
Witte fosfor
Hetzelfde beeld van P-eenheden4 en zijn instabiliteit verklaren waarom witte fosfor de meest onstabiele allotroop van dit element is.
Eenheden P4 ze zijn in de ruimte gerangschikt om onder normale omstandigheden een bcc-kristal (α-fase) te definiëren. Wanneer de temperatuur daalt tot -77,95 ° C, verandert het bcc-kristal in een dichtere hcp (vermoedelijk) (β-fase). Dat wil zeggen, de eenheden P4 ze zijn gerangschikt in twee afwisselende lagen, A en B, om een ABAB-reeks tot stand te brengen ...
Rode fosfor
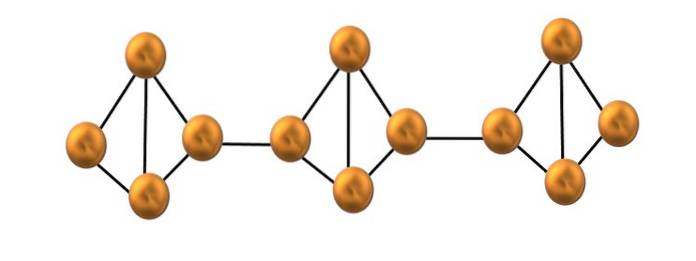
In de bovenste afbeelding is slechts een klein deel van de rode fosforstructuur te zien. Aangezien de drie eenheden "symmetrisch" zijn uitgelijnd, kan worden gezegd dat het een kristallijne structuur is, die wordt verkregen door deze fosfor boven 250 ºC te verhitten..
Rode fosfor bestaat echter meestal uit een amorfe vaste stof, dus de structuur is rommelig. Vervolgens worden de polymeerketens van P4 zou zonder duidelijk patroon worden gerangschikt, sommige boven en andere willekeurig onder hetzelfde vlak.
Merk op dat dit het belangrijkste structurele verschil is tussen witte en rode fosfor: in de eerste is de P4 ze zijn individueel, en in de tweede vormende ketens. Dit is mogelijk omdat een van de P-P-bindingen binnen de tetraëder wordt verbroken om zich te binden aan de naburige tetraëder. Zo wordt de ringvormige spanning verminderd en krijgt de rode fosfor meer stabiliteit..
Als er een mengsel is van beide allotropen, wordt het aan het oog aangeboden als een gele fosfor; een mengsel van tetraëders en amorfe fosforketens. In feite wordt witte fosfor gelig bij blootstelling aan zonnestralen, aangezien de straling het verbreken van de reeds genoemde P-P-binding bevordert..
Violet of Hittorf-fosfor
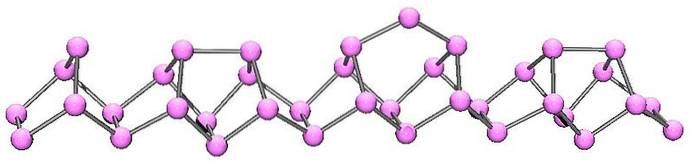
Violette fosfor is de laatste evolutie van rode fosfor. Zoals te zien is in de afbeelding hierboven, bestaat het nog steeds uit een polymeerketen; maar nu zijn de structuren ingewikkelder. Het lijkt erop dat de structurele eenheid niet langer de P is4 maar de Ptwee, zo gerangschikt dat ze onregelmatige vijfhoekige ringen vormen.
Ondanks hoe asymmetrisch de structuur eruitziet, slagen deze polymeerketens erin zichzelf goed genoeg en met periodiciteit te rangschikken zodat de violette fosfor monokliene kristallen kan vormen..
Zwarte fosfor
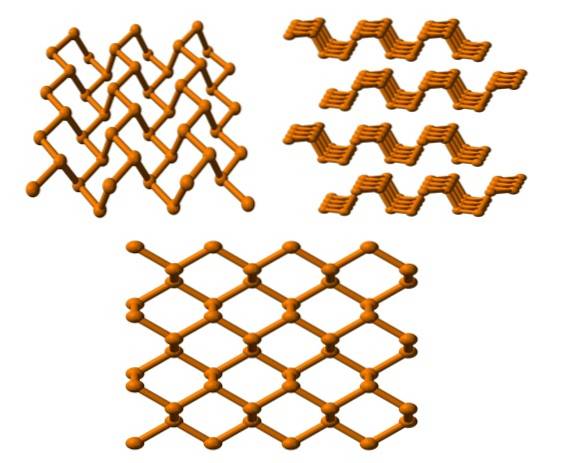
En tot slot hebben we de meest stabiele fosforallotroop: de zwarte. Het wordt bereid door witte fosfor te verhitten onder een druk van 12.000 atm.
In de bovenste afbeelding (hieronder) is te zien dat de structuur ervan, vanuit een hoger vlak, een zekere gelijkenis vertoont met die van grafiet; is een steil netwerk van zeshoekige ringen (zelfs als ze op vierkanten lijken).
In de linkerbovenhoek van de afbeelding kan wat zojuist is opgemerkt beter worden gewaardeerd. De moleculaire omgeving van de P-atomen zijn trigonale piramides. Merk op dat de structuur, gezien vanaf de zijkant (rechterbovenhoek), is gerangschikt in lagen die op elkaar passen.
De structuur van zwarte fosfor is vrij symmetrisch en geordend, wat consistent is met het vermogen om zichzelf te vestigen als orthorhombische kristallen. Door de opeenstapeling van hun polymere lagen zijn de P-atomen niet beschikbaar voor veel chemische reacties; en daarom is het aanzienlijk stabiel en niet erg reactief.
Hoewel het vermeldenswaard is, zijn de Londense dispersiekrachten en de molaire massa van deze fosforhoudende vaste stoffen wat bepalend is voor enkele van hun fysische eigenschappen; terwijl hun structuren en P-P-bindingen de chemische en andere eigenschappen bepalen.
Waar te vinden en te verkrijgen
Apatiet en fosforiet
Het is het twaalfde element van de aardkorst en vertegenwoordigt 0,1% van het gewicht. Er zijn ongeveer 550 mineralen die fosfor bevatten, waarbij apatiet het belangrijkste mineraal is voor het verkrijgen van fosfor..
Apatiet is een mineraal van fosfor en calcium dat variabele hoeveelheden fluor, chloride en hydroxide kan bevatten, waarvan de formule de volgende is: [Ca10(PO46(F, Cl of OH)tweeBehalve apatiet zijn er nog andere fosforhoudende mineralen van commercieel belang; dat is het geval met wavelita en vivianita.
Fosfaatgesteente of fosforiet is de belangrijkste bron van fosfor. Het is een niet-detritisch sedimentair gesteente met een fosforgehalte van 15-20%. Fosfor is meestal aanwezig als Ca10(PO46F.twee (fluorapatiet). Het is ook aanwezig als hydroxyapatiet, zij het in mindere mate.
Bovendien kan fluorapatiet worden gevonden als onderdeel van stollingsgesteenten en metamorfe gesteenten, evenals kalksteen en leisteen..
Elektrothermische reductie van fluorapatiet
De geselecteerde fosfaatgesteenten worden overgebracht naar de zuiveringsinstallatie voor verwerking. In eerste instantie worden ze verpletterd om rotsachtige fragmenten te verkrijgen die vervolgens worden vermalen in kogelmolens met 70 omwentelingen per minuut.
Vervolgens wordt het product van het vermalen van de gesteentefragmenten gezeefd om ze te kunnen fractioneren. Die fracties met een fosforgehalte van 34% worden gekozen als fosforpentoxide (PtweeOF5.
Witte fosfor (P4) wordt industrieel verkregen door elektrothermische reductie van fluorapatiet met koolstof bij een temperatuur van 1.500 ºC in aanwezigheid van siliciumoxide:
2Ca3(PO4twee(s) + 6SiOtwee(s) + 10 C (s) => P4(g) + CaSiO3(l) + CO (g)
De P4 in gasvormige toestand, na condensatie, wordt het verzameld en opgeslagen als een witte vaste stof ondergedompeld in water om te voorkomen dat het reageert met de buitenlucht.
Legeringen
Koperachtig
De fosfordeken is vervaardigd met verschillende percentages koper en fosfor: Cu 94% - P 6%; Cu 92% - P 8%; Cu 85% - P 15%, enz. De legering wordt gebruikt als desoxidatiemiddel, bevochtigingsmiddel voor de koperindustrie en ook als kernstof in de aluminiumindustrie.
Broncíneas
Het zijn koper-, fosfor- en tinlegeringen die 0,5 - 11% fosfor en 0,01 - 0,35% tin bevatten. Tin verhoogt de weerstand tegen corrosie, terwijl fosfor de slijtvastheid van de legering verhoogt en deze stijfheid geeft.
Het wordt gebruikt bij de vervaardiging van veren, bouten en in het algemeen in artikelen die bestand moeten zijn tegen vermoeidheid, slijtage en chemische corrosie. Het gebruik ervan wordt aanbevolen in de propellers van de boten.
Vernikkeld
De bekendste legering is NiPtwintig, het gebruik van fosfor-nikkel in soldeerlegeringen om hun weerstand tegen chemische erosie, oxidatie en hoge temperaturen te verbeteren.
De legering wordt gebruikt in onderdelen van gasturbines en straalmotoren, galvaniseren en bij de productie van laselektroden.
Risico's
Witte fosfor veroorzaakt ernstige brandwonden op de huid en is een krachtig gif dat bij een dosis van 50 mg dodelijk kan zijn. Fosfor remt cellulaire oxidatie en interfereert met cellulair zuurstofbeheer, wat kan leiden tot vervetting en celdood.
Acute fosforvergiftiging veroorzaakt binnen de eerste vier dagen na inname buikpijn, brandende, naar knoflook ruikende adem, fosforescerend braken, zweten, spierkrampen en zelfs een shocktoestand..
Later geelzucht, petechiën, bloeding, myocardiale betrokkenheid met aritmieën, verandering van het centrale zenuwstelsel en overlijden op de tiende dag na inname..
De meest voor de hand liggende manifestatie van chronische fosforvergiftiging is schade aan de botstructuur van de kaak.
Een verhoging van de plasmafosforconcentratie (hyperfosfatemie) treedt meestal op bij patiënten met nierfalen. Dit veroorzaakt een abnormale afzetting van fosfaten in zachte weefsels, wat kan leiden tot vasculaire disfunctie en hart- en vaatziekten..
Toepassingen
Fosfor is een essentieel element voor planten en dieren. Het is een van de drie belangrijkste voedingsstoffen van planten, die nodig zijn voor hun groei en energiebehoefte. Bovendien maakt het deel uit van nucleïnezuren, fosfolipiden, tussenproducten van metabolische processen, enz..
Bij gewervelde dieren is fosfor aanwezig in botten en tanden in de vorm van hydroxylapatiet..
- Elementair fosfor

Met fosfor wordt een chemisch email gemaakt dat wordt gebruikt om borden op aluminium en zijn legeringen te verlichten; evenals fosfor koper en brons.
Het wordt ook gebruikt om brandbommen, granaten, rookbommen en tracerkogels te maken. Rode fosfor wordt gebruikt om lucifers of veiligheidslucifers te maken.
Witte fosfor wordt gebruikt om organofosfaten te maken. Bovendien wordt het gebruikt bij de productie van fosforzuur.
Een groot deel van het geproduceerde fosfor wordt verbrand voor de productie van fosfortetraoxide (P.4OF10), verkregen als poeder of vaste stof.
- Verbindingen
Fosfine
Het is de grondstof voor de productie van verschillende fosforverbindingen. Fungeert als dopingmiddel voor elektronische componenten.
Fosforzuur
Het wordt gebruikt bij de productie van frisdranken vanwege de karakteristieke smaak die het eraan geeft. Het werkt op fosfaatgesteenten om diwaterstofcalciumfosfaat te vormen [Ca (HtweePO4twee], ook wel superfosfaat genoemd, dat als meststof wordt gebruikt.
Fosforzuur is een verzorgend element van tandglazuur om de hechting van uw restauratiemateriaal te vergemakkelijken. Het wordt ook gebruikt, gemengd met olie, ureum, teer, bitumen en zand, om asfalt te vormen; materiaal dat wordt gebruikt bij het repareren van communicatieroutes over land.
Organofosfaten
Organofosfaatverbindingen hebben talrijke toepassingen; zoals: vlamvertragers, pesticiden, extractiemiddelen, zenuwwerkende middelen en voor waterbehandeling.
Diwaterstof calciumfosfaat dihydraat
Het wordt gebruikt als meststof, bakpoeder, additief voor diervoeding en bij de vervaardiging van tandpasta's.
Fosforpentoxide
Het wordt gebruikt bij chemische analyse als een dehydratatiemiddel en bij organische synthese als een condensatiemiddel. De verbinding is voornamelijk bedoeld voor de productie van orthofosforzuur.
Natriumtripolyfosfaat
Wordt gebruikt in wasmiddelen en als waterontharder, wat de werking van wasmiddelen verbetert en corrosie van leidingen helpt voorkomen.
Trinatrium fosfaat
Gebruikt als reinigingsmiddel en waterontharder.
Natriumfosfaten
Dibasisch natriumfosfaat (NatweeHPO4) en monobasisch natriumfosfaat (NaHtweePO4) zijn de componenten van een pH-buffersysteem, dat zelfs inwerkt op levende wezens; inclusief mensen.
Referenties
- Reid Danielle. (2019). Allotropen van fosfor: vormen, toepassingen en voorbeelden. Studie. Hersteld van: study.com
- Prof. Robert J. Lancashire. (2014). Hoorcollege 5c. Structuur van de elementen, vervolg P, S en I. Hersteld van: chem.uwimona.edu.jm
- BYJU'S. (2019). Rode fosfor. Hersteld van: byjus.com
- Bing Li, Ceng-Ceng Ren, Shu-Feng Zhang, et al. (2019). Elektronische structurele en optische eigenschappen van meerlagige blauwe fosfor: een eerste principeonderzoek. Journal of Nanomaterials, vol. 2019, artikel-ID 4020762, 8 pagina's. doi.org/10.1155/2019/4020762
- Dr. Dough Stewar. (2019). Feiten over fosforelement. Chemicool. Hersteld van: chemicool.com
- Wikipedia. (2019). Fosfor. Hersteld van: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (3 juli 2019). Fosforfeiten (atoomnummer 15 of elementsymbool P). Hersteld van: thoughtco.com
- Linus Pauling Institute. (2019). Fosfor. Hersteld van: lpi.oregonstate.edu
- Bernardo Fajardo P. & Héctor Lozano V. (s.f.). Nationale verwerking van fosfaatgesteente voor superfosfaatproductie. [Pdf]. Hersteld van: bdigital.unal.edu.co
- De redactie van Encyclopaedia Britannica. (16 november 2018). Fosfor Chemisch Element. Encyclopædia Britannica. Hersteld van: britannica.com
- Reade International Corp. (2018). Koperfosfor (CuP) legering. Hersteld van: reade.com
- KBM Affilips. (27 december 2018). Nikkelfosfor (NiP) hoofdlegering. AZoM. Hersteld van: azom.com
- Lenntech B.V. (2019). Periodiek systeem: fosfor. Hersteld van: lenntech.com
- Abhijit Naik. (2018, 21 februari). Fosfor gebruikt. Hersteld van: sciencestruck.com



Niemand heeft nog op dit artikel gereageerd.