
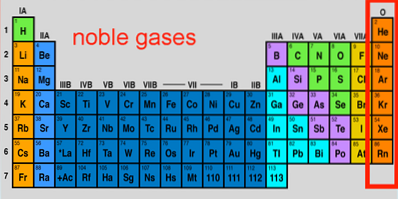
Eigenschappen, configuratie, reacties, gebruik van edelgassen

De Edele gassen Ze zijn een reeks elementen die worden aangetroffen in groep 18 van het periodiek systeem. In de loop der jaren zijn ze ook wel zeldzame of inerte gassen genoemd, die beide onnauwkeurig zijn; sommigen van hen zijn zeer overvloedig buiten en binnen planeet Aarde, en ze zijn ook in staat om onder extreme omstandigheden te reageren.
De zeven elementen vormen misschien wel de meest unieke groep in het periodiek systeem, waarvan de eigenschappen en lage reactiviteit even indrukwekkend zijn als die van de edele metalen. Onder hen paradeert het meest inerte element (neon), het op een na meest voorkomende element van de kosmos (helium) en het zwaarste en meest onstabiele (oganeson).

Edelgassen zijn de koudste stoffen in de natuur; bestand tegen zeer lage temperaturen alvorens te condenseren. Nog moeilijker is het bevriezen ervan, aangezien de intermoleculaire krachten gebaseerd op de Londense verstrooiing en de polariseerbaarheid van de atomen te zwak zijn om ze nauwelijks samenhangend te houden in een kristal..
Door hun lage reactiviteit zijn het relatief veilige gassen om op te slaan en vormen ze niet al te veel risico's. Ze kunnen echter zuurstof uit de longen verdringen en verstikking veroorzaken bij overmatige inademing. Aan de andere kant zijn twee van zijn leden zeer radioactieve elementen en daarom dodelijk voor de gezondheid..
De lage reactiviteit van edelgassen wordt ook gebruikt om de reacties van een inerte atmosfeer te voorzien; zodat geen enkel reagens of product het risico loopt te oxideren en de prestatie van de synthese te beïnvloeden. Dit is ook in het voordeel van elektrische booglasprocessen..
Aan de andere kant zijn het in hun vloeibare toestand uitstekende cryogene koelmiddelen die de laagste temperaturen garanderen, essentieel voor de juiste werking van hoogenergetische apparatuur, of voor sommige materialen om een toestand van supergeleiding te bereiken..
Artikel index
- 1 Kenmerken van edelgassen
- 2 De 7 edelgassen
- 3 Elektronische configuratie
- 4 Polariseerbaarheid
- 5 reacties
- 5.1 Helium en neon
- 5.2 Argon en krypton
- 5.3 Xenon en radon
- 6 Productie
- 6.1 Luchtvervloeiing
- 6.2 Destillatie van aardgas en radioactieve mineralen
- 7 gevaren
- 8 toepassingen
- 8.1 Industrie
- 8.2 Ballonnen en ademtanks
- 8.3 Geneeskunde
- 8.4 Andere
- 9 referenties
Edelgaskenmerken
Misschien zijn edelgassen de elementen die de meeste eigenschappen gemeen hebben, zowel fysisch als chemisch. De belangrijkste kenmerken zijn:
- Ze zijn allemaal kleurloos, geurloos en smaakloos; maar wanneer ze zijn ingesloten in ampullen met lage druk en ze een elektrische schok krijgen, ioniseren ze en geven ze kleurrijke lichten af (bovenste afbeelding).
- Elk edelgas heeft zijn eigen licht en spectrum.
- Het zijn mono-atomaire soorten, de enigen in het periodiek systeem die in hun respectievelijke fysieke toestand kunnen bestaan zonder de deelname van chemische bindingen (aangezien metalen worden verbonden door metaalbinding). Daarom zijn ze perfect voor het bestuderen van de eigenschappen van gassen, omdat ze zich zeer goed aanpassen aan het sferische model van een ideaal gas..
- Dit zijn over het algemeen de elementen met het laagste smelt- en kookpunt; zozeer zelfs dat helium niet eens bij het absolute nulpunt kan kristalliseren zonder een toename van de druk.
- Van alle elementen zijn ze het minst reactief, nog minder dan de edelmetalen.
- Hun ionisatie-energieën zijn het hoogst, evenals hun elektronegativiteiten, ervan uitgaande dat ze puur covalente bindingen vormen..
- De atoomstralen zijn ook de kleinste omdat ze zich aan de rechterkant van elke periode bevinden..
De 7 edelgassen
De zeven edelgassen lopen van boven naar beneden door groep 18 van het periodiek systeem:
-Helium, He
-Neon, Ne

-Argon, Ar
-Krypton, Kr
-Xenon, Xe

-Radon, Rn
-Oganeson, Og
Ze zijn allemaal, behalve de onstabiele en kunstmatige oganeson, bestudeerd vanwege hun fysische en chemische eigenschappen. Oganeson, vanwege zijn grote atomaire massa, wordt verondersteld niet eens een gas te zijn, maar een edele vloeistof of vaste stof. Er is weinig bekend over radon, vanwege zijn radioactiviteit, in relatie tot helium of argon.
Elektronische configuratie
Van edelgassen wordt gezegd dat hun valentieschil volledig is gevuld. Zozeer zelfs dat hun elektronische configuraties worden gebruikt om die van andere elementen te vereenvoudigen door hun symbolen tussen vierkante haken te gebruiken ([He], [Ne], [Ar], enz.). De elektronische configuraties zijn:
-Helium: 1stwee, [Hij] (2 elektronen)
-Neon: 1stwee2 sectwee2 Blz6, [Ne] (10 elektronen)
-Argon: 1stwee2 sectwee2 Blz63stwee3p6, [Ar] (18 elektronen)
-Krypton: 1stwee2 sectwee2 Blz63stwee3p63d104stwee4p6, [Kr] (36 elektronen)
-Xenon: 1stwee2 sectwee2 Blz63stwee3p63d104stwee4p64d105stwee5 p6, [Xe] (54 elektronen)
-Radon: 1stwee2 sectwee2 Blz63stwee3p63d104stwee4p64d104f145stwee5 p65 d106stwee6p6, [Rn] (86 elektronen)
Het belangrijkste is om ze niet te onthouden, maar om te specificeren dat ze eindigen op nstweenp6: het valentie-octet. Evenzo wordt ingezien dat zijn atomen veel elektronen hebben, die vanwege de grote effectieve kernkracht in een kleiner volume worden aangetroffen in vergelijking met dat van de andere elementen; dat wil zeggen, hun atoomstralen zijn kleiner.
Daarom vertonen hun elektronisch dichte atoomstralen een chemische eigenschap die alle edelgassen gemeen hebben: ze zijn moeilijk te polariseren..
Polariseerbaarheid
Edelgassen kunnen worden voorgesteld als bollen van elektronenwolken. Bij het afdalen door groep 18 nemen de stralen ervan toe, en op dezelfde manier neemt de afstand tussen de kern en de valentie-elektronen (die van de nstweenp6.
Deze elektronen kunnen, door een minder aantrekkelijke kracht van de kern van de kern te voelen, vrijer bewegen; de bollen worden gemakkelijker vervormd naarmate ze volumineuzer zijn. Als gevolg van dergelijke bewegingen verschijnen gebieden met lage en hoge elektronendichtheden: de δ + en δ polen-.
Wanneer het atoom van een edelgas gepolariseerd is, wordt het een instantane dipool die in staat is om een ander naar het naburige atoom te induceren; dat wil zeggen, we worden geconfronteerd met de verspreidende krachten van Londen.
Dat is de reden waarom intermoleculaire krachten toenemen van helium tot radon, weerspiegeld in hun stijgende kookpunten; en niet alleen dat, maar hun reactiviteiten worden ook vergroot.
Naarmate atomen meer gepolariseerd raken, is de kans groter dat hun valentie-elektronen deelnemen aan chemische reacties, waarna edelgasverbindingen worden gegenereerd..
Reacties
Helium en neon
Van de edelgassen zijn helium en neon de minst reactieve. Neon is in feite het meest inerte element van allemaal, hoewel de elektronegativiteit (door het vormen van covalente bindingen) groter is dan die van fluor..
Geen van zijn verbindingen is bekend onder aardse omstandigheden; In de Kosmos is het bestaan van het moleculaire ion HeH echter vrij waarschijnlijk+. Evenzo zijn ze, wanneer ze elektronisch geëxciteerd worden, in staat om in wisselwerking te treden met gasvormige atomen en kortstondige neutrale moleculen te vormen die excimeren worden genoemd; zoals HeNe, CsNe en Netwee.
Aan de andere kant, hoewel ze in formele zin niet als verbindingen worden beschouwd, kunnen He- en Ne-atomen aanleiding geven tot Van der Walls-moleculen; dat wil zeggen, verbindingen die eenvoudig "bijeen" worden gehouden door verspreidende krachten. Bijvoorbeeld: Ag3Hij, HeCO, HeItwee, CF4Ne, Ne3Cltwee en NeBeCO3.
Evenzo kunnen dergelijke Van der Walls-moleculen bestaan dankzij zwakke ion-geïnduceerde dipoolinteracties; bijvoorbeeld: Na+ik heb8, Rb+Hij, Cu+Ne3 en Cu+Ne12. Merk op dat het zelfs mogelijk is dat deze moleculen agglomeraten van atomen worden: clusters.
En tenslotte kunnen He- en Ne-atomen worden 'gevangen' of tussengevoegd in endohedrale complexen van fullerenen of clathraten, zonder te reageren; bijvoorbeeld: [e-mail beveiligd]60, (Ntwee6Ne7, Hij (HtweeOF)6 en Ne • NH4Fe (HCOO)3.
Argon en krypton
De edelgassen argon en krypton, omdat ze beter polariseerbaar zijn, hebben de neiging om meer "verbindingen" te vertonen dan helium en neon. Een deel ervan is echter stabieler en karakteristieker, omdat ze een langere levensduur hebben. Enkele daarvan zijn HArF en het moleculaire ion ArH+, aanwezig in nevels door de werking van kosmische straling.
Van krypton begint de mogelijkheid om verbindingen te verkrijgen in extreme, maar duurzame omstandigheden. Dit gas reageert met fluor volgens de volgende chemische vergelijking:
Kr + Ftwee → KrFtwee
Merk op dat krypton een oxidatiegetal krijgt van +2 (Krtwee+) dankzij fluoride. De KrFtwee in feite kan het in verhandelbare hoeveelheden worden gesynthetiseerd als een oxiderend en fluoreringsmiddel.
Argon en krypton kunnen een breed repertoire vormen van clathraten, endohedrale complexen, Van der Walls-moleculen en sommige verbindingen die wachten op ontdekking na hun voorspelde bestaan..
Xenon en radon
Xenon is, onder de edelgassen, de koning van reactiviteit. Het vormt de werkelijk stabiele, verhandelbare en karakteristieke verbindingen. In feite lijkt zijn reactiviteit op die van zuurstof onder de juiste omstandigheden..
Zijn eerste gesynthetiseerde verbinding was “XePtF6", In 1962 door Neil Bartlett. Dit zout bestond volgens de literatuur eigenlijk uit een complex mengsel van andere gefluoreerde zouten van xenon en platina.
Dit was echter meer dan voldoende om de affiniteit tussen xenon en fluor aan te tonen. Onder enkele van deze verbindingen hebben we: XeFtwee, XeF4, XeF6 en [XeF]+[PtF5. Toen de XeF6 lost op in water, genereert een oxide:
XeF6 + 3 H.tweeO → XeO3 + 6 HF
Deze XeO3 kan de soort voortbrengen die bekend staat als xenatos (HXeO4-) of xeenzuur (H.tweeXeO4Xenaten staan niet in verhouding tot perxenaten (XeO64-en als het medium vervolgens wordt aangezuurd, in peroxeenzuur (H.4XeO6), die is gedehydrateerd tot xenontetroxide (XeO4
H.4XeO6 → 2 H.tweeO + XeO4
Radon zou het meest reactieve van de edelgassen moeten zijn; Maar het is zo radioactief dat het nauwelijks tijd heeft om te reageren voordat het uiteenvalt. De enige verbindingen die volledig zijn gesynthetiseerd, zijn fluoride (RnFtwee) en oxide (RnO3.
Productie
Luchtvervloeiing
De edelgassen worden overvloediger in het heelal naarmate we afdalen door groep 18. In de atmosfeer is helium echter schaars, aangezien het zwaartekrachtveld van de aarde het niet kan vasthouden in tegenstelling tot andere gassen. Daarom werd het niet gedetecteerd in de lucht maar in de zon.
Aan de andere kant zijn er in de lucht opmerkelijke hoeveelheden argon, afkomstig van het radioactieve verval van de radio-isotoop 40K. Lucht is de belangrijkste natuurlijke bron van argon, neon, krypton en xenon op aarde.
Om ze te produceren, moet de lucht eerst vloeibaar worden gemaakt, zodat deze tot een vloeistof condenseert. Vervolgens ondergaat deze vloeistof een gefractioneerde destillatie, waarbij elk van de componenten van het mengsel (N.twee, OFtwee, COtwee, Ar, enz.).
Afhankelijk van hoe laag de temperatuur en de hoeveelheid gas moet zijn, stijgen de prijzen ervan, waarbij xenon het duurste is, terwijl helium het goedkoopste is..
Destillatie van aardgas en radioactieve mineralen
Helium wordt op zijn beurt verkregen uit een andere gefractioneerde destillatie; maar niet uit de lucht, maar uit aardgas, verrijkt met helium dankzij het vrijkomen van alfadeeltjes uit de radioactieve mineralen thorium en uranium.
Evenzo wordt radon "geboren" uit het radioactieve verval van radium in zijn respectievelijke mineralen; maar vanwege hun lagere overvloed, en de korte halfwaardetijd van de Rn-atomen, is hun overvloed belachelijk in vergelijking met die van hun soortgenoten (de andere edelgassen).
En tot slot is oganeson een zeer radioactief, ultramassisch, door de mens gemaakt edel "gas" dat slechts kortstondig kan bestaan onder gecontroleerde omstandigheden in een laboratorium..
Gevaren
Het belangrijkste risico van edelgassen is dat ze het gebruik van zuurstof door de mens beperken, vooral wanneer een atmosfeer met een hoge concentratie ervan wordt geproduceerd. Daarom wordt het niet aanbevolen om ze overmatig in te ademen..
In de Verenigde Staten is een hoge concentratie radon gedetecteerd in bodems die rijk zijn aan uranium, wat vanwege de radioactieve eigenschappen een gezondheidsrisico zou kunnen vormen.
Toepassingen
Industrie
Helium en argon worden gebruikt om een inerte atmosfeer te creëren voor bescherming tijdens lassen en snijden. Bovendien worden ze gebruikt bij de vervaardiging van halfgeleiders van silicium. Helium wordt gebruikt als vulgas in thermometers.
Argon wordt in combinatie met stikstof gebruikt bij de vervaardiging van gloeilampen. Krypton gemengd met halogenen, zoals broom en jodium, wordt gebruikt in ontladingslampen. Neon wordt gebruikt in lichtborden, vermengd met fosforen en andere gassen om zijn rode kleur te kleuren.
Xenon wordt gebruikt in booglampen die licht uitstralen dat lijkt op daglicht, die worden gebruikt in autokoplampen en projectoren. De edelgassen worden gemengd met halogenen om ArF, KrF of XeCl te produceren, die worden gebruikt bij de productie van excimeerlasers.
Dit type laser produceert kortgolvig ultraviolet licht dat zeer nauwkeurige beelden produceert en wordt gebruikt bij de vervaardiging van geïntegreerde schakelingen. Helium en neon worden gebruikt als cryogene koelgassen.
Ballonnen en ademhalingstanks
Helium wordt gebruikt ter vervanging van stikstof in het ademhalingsgasmengsel, vanwege de lage oplosbaarheid in het lichaam. Dit voorkomt de vorming van bellen tijdens de decompressiefase tijdens de opstijging, naast het elimineren van de stikstofnarcose.
Helium heeft waterstof vervangen als het gas dat luchtschepen en heteluchtballonnen omhoog brengt, omdat het een licht en onbrandbaar gas is..
Geneesmiddel
Helium wordt gebruikt bij de vervaardiging van supergeleidende magneten die worden gebruikt in apparatuur voor nucleaire magnetische resonantie: een hulpmiddel voor meerdere toepassingen in de geneeskunde.
Krypton wordt gebruikt in halogeenlampen die worden gebruikt bij ooglaseren en angioplastiek. Helium wordt gebruikt om de ademhaling bij astmapatiënten te vergemakkelijken.
Xenon wordt gebruikt als verdovingsmiddel vanwege de hoge oplosbaarheid van lipiden en wordt beschouwd als het verdovingsmiddel van de toekomst. Xenon wordt ook gebruikt bij medische beeldvorming van de longen.
Radon, een radioactief edelgas, wordt gebruikt bij bestralingstherapie voor sommige soorten kanker.
Anderen
Argon wordt gebruikt bij de synthese van verbindingen die stikstof als inerte atmosfeer vervangen. Helium wordt gebruikt als draaggas in gaschromatografie, maar ook in geigertellers om straling te meten.
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8e ed.). CENGAGE Leren.
- Helmenstine, Anne Marie, Ph.D. (06 juni 2019). Eigenschappen, toepassingen en bronnen van edelgassen. Hersteld van: thoughtco.com
- Wikipedia. (2019). Edelgas. Hersteld van: en.wikipedia.org
- Philip Ball. (18 januari 2012). Onmogelijke chemie: edelgassen dwingen om te werken. Hersteld van: newscientist.com
- Professor Patricia Shapley. (2011). Noble Gas Chemistry. Hersteld van: butane.chem.uiuc.edu
- Gary J. Schrobilgen. (28 februari 2019). Edelgas. Encyclopædia Britannica. Hersteld van: britannica.com



Niemand heeft nog op dit artikel gereageerd.