
Hydracid-kenmerken, nomenclatuur, toepassingen en voorbeelden

De hydraciden of binaire zuren zijn verbindingen die zijn opgelost in water en die bestaan uit waterstof en een niet-metallisch element: waterstofhalogeniden. De algemene chemische formule kan worden uitgedrukt als HX, waarbij H het waterstofatoom is en X het niet-metallische element..
X kan behoren tot groep 17, de halogenen, of tot de elementen van groep 16 zonder zuurstof op te nemen. In tegenstelling tot oxozuren hebben hydraciden zuurstof tekort. Omdat hydraciden covalente of moleculaire verbindingen zijn, moet de H-X-binding worden overwogen. Dit is van groot belang en bepaalt de kenmerken van elk hydracide..
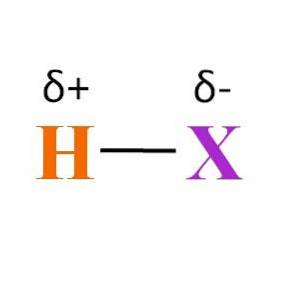
Hoe zit het met de H-X-binding? Zoals te zien is in de afbeelding hierboven, is er een permanent dipoolmomentproduct van de verschillende elektronegativiteiten tussen H en X. Omdat X meestal elektronegatiever is dan H, trekt het zijn elektronische wolk aan en eindigt het met een negatieve deellading δ-.
Aan de andere kant, door een deel van zijn elektronendichtheid aan X te geven, krijgt het een positieve deellading δ +. Hoe negatiever δ-, hoe rijker aan elektronen X zal zijn en hoe groter het elektronendeficiëntie van H.Daarom, afhankelijk van welk element X is, kan een hydracide meer of minder polair zijn..
De afbeelding laat ook de structuur van de hydraciden zien. H-X is een lineair molecuul dat aan een van zijn uiteinden met een ander kan interageren. Hoe meer polair HX is, des te sterker of de affiniteit waarmee de moleculen zullen interageren. Als gevolg hiervan zullen het kook- of smeltpunt toenemen.
De H-X - H-X-interacties zijn echter nog steeds zwak genoeg om aanleiding te geven tot een vast hydracide. Om deze reden zijn het onder omstandigheden van druk en omgevingstemperatuur gasvormige stoffen; Met uitzondering van HF, dat verdampt boven 20ºC.
Waarom? Omdat HF sterke waterstofbruggen kan vormen. Terwijl de andere hydraciden, waarvan de niet-metalen elementen minder elektronegatief zijn, kunnen ze zich nauwelijks in de vloeistoffase bevinden onder 0 ° C. HCl kookt bijvoorbeeld bij ongeveer -85ºC.
Zijn hydraciden zure stoffen? Het antwoord ligt in de positieve deellading δ + op het waterstofatoom. Als 8 + erg groot is of de H-X-binding erg zwak is, dan zal HX een sterk zuur zijn; zoals bij alle hydrozuren van halogenen, zodra hun respectievelijke halogeniden in water zijn opgelost.
Artikel index
- 1 Kenmerken
- 1.1 Fysiek
- 1.2 Chemie
- 2 Nomenclatuur
- 2.1 Watervrije vorm
- 2.2 In waterige oplossing
- 3 Hoe worden ze gevormd?
- 3.1 Direct oplossen van waterstofhalogeniden
- 3.2 Oplossen van zouten van niet-metalen met zuren
- 4 toepassingen
- 4.1 Reinigingsmiddelen en oplosmiddelen
- 4.2 Zure katalysatoren
- 4.3 Reagentia voor de synthese van organische en anorganische verbindingen
- 5 voorbeelden
- 5.1 HF, fluorwaterstofzuur
- 5.2 H2S, waterstofsulfide
- 5.3 HCl, zoutzuur
- 5.4 HBr, broomwaterstofzuur
- 5,5 H2Te, tellurwaterzuur
- 6 referenties
Kenmerken
Fysiek
-Zichtbaar zijn alle hydraciden transparante oplossingen, aangezien HX zeer goed oplosbaar is in water. Ze kunnen gelige tinten hebben, afhankelijk van de concentraties opgeloste HX.
-Het zijn rokers, wat betekent dat ze dichte, bijtende en irriterende dampen afgeven (sommige zijn zelfs misselijkmakend). Dit komt omdat de HX-moleculen erg vluchtig zijn en een wisselwerking hebben met de waterdamp in het medium dat de oplossingen omgeeft. Bovendien zijn HX in zijn watervrije vormen gasvormige verbindingen..
-Hydraciden zijn goede geleiders van elektriciteit. Hoewel HX onder atmosferische omstandigheden gasvormige soorten zijn, geven ze bij oplossen in water ionen vrij (H.+X-), die de doorgang van elektrische stroom mogelijk maken.
-De kookpunten zijn hoger dan die van de watervrije vormen. Dat wil zeggen, HX (ac), wat het hydracide aanduidt, kookt bij temperaturen boven HX (g). Bijvoorbeeld, waterstofchloride, HCl (g), kookt bij -85 ° C, maar zoutzuur, het hydracide ervan, rond de 48 ° C..
Waarom? Omdat de gasvormige HX-moleculen omgeven zijn door die van water. Er kunnen twee soorten interacties tegelijkertijd optreden: waterstofbruggen, HX - HtweeO - HX, of ion solvatatie, H3OF+(ac) en X-(ac). Dit feit houdt rechtstreeks verband met de chemische eigenschappen van hydraciden..
Chemisch
Hydraciden zijn zeer zure oplossingen, dus ze hebben zure protonen H.3OF+ beschikbaar om te reageren met andere stoffen. Waar komt de H3OF+? Van het waterstofatoom met een positieve partiële lading δ +, die dissocieert in water en uiteindelijk covalent wordt opgenomen in een watermolecuul:
HX (aq) + HtweeO (l) <=> X-(ac) + H3OF+(ac)
Merk op dat de vergelijking overeenkomt met een reactie die een evenwicht tot stand brengt. Toen de vorming van X-(ac) + H3OF+(ac) thermodynamisch sterk de voorkeur heeft, zal HX zijn zure proton in water afgeven; en dan deze, met H3OF+ als zijn nieuwe ‘drager’ kan het reageren met een andere verbinding, zelfs als deze geen sterke base is.
Het bovenstaande verklaart de zure eigenschappen van hydraciden. Dit is het geval voor alle HX opgelost in water; maar sommige genereren zuurdere oplossingen dan andere. Voor wat is dit? De redenen kunnen erg ingewikkeld zijn. Niet alle HX (ac) geven de voorkeur aan het anterieure evenwicht naar rechts, dat wil zeggen naar X-(ac) + H3OF+(ac).
Zuurgraad
En de uitzondering wordt waargenomen in fluorwaterstofzuur, HF (aq). Fluor is erg elektronegatief, daarom verkort het de afstand van de H-X-binding en versterkt het deze tegen afbraak door de werking van water..
Evenzo heeft de H-F-binding een veel betere overlapping om redenen van atomaire straal. Aan de andere kant zijn de H-Cl-, H-Br- of H-I-bindingen zwakker en hebben ze de neiging volledig te dissociëren in water, tot het punt dat de hierboven genoemde balans wordt verbroken..
Dit komt doordat de andere halogenen of chalcogenen (bijvoorbeeld zwavel) grotere atoomstralen hebben en dus grotere orbitalen. Bijgevolg vertoont de H-X-binding een slechtere orbitale overlapping omdat X groter is, wat op zijn beurt de zuurkracht beïnvloedt wanneer deze in contact komt met water..
Op deze manier is de afnemende volgorde van zuurgraad voor de hydrozuren van de halogenen als volgt: HF< HCl Hoe worden hydraciden genoemd? In hun watervrije vorm, HX (g), moeten ze worden vermeld zoals gedicteerd voor waterstofhalogeniden: het achtervoegsel -ide toevoegen aan het einde van hun namen. HI (g) bestaat bijvoorbeeld uit een halogenide (of hydride) gevormd door waterstof en jodium, daarom is de naam: joodoeros waterstof. Omdat niet-metalen over het algemeen elektronegatiever zijn dan waterstof, heeft het een oxidatiegetal van +1. In NaH daarentegen heeft waterstof een oxidatiegetal van -1. Dit is een andere indirecte manier om moleculaire hydriden te onderscheiden van halogenen of waterstofhalogeniden van andere verbindingen.. Zodra HX (g) in contact komt met water, wordt het weergegeven als HX (ac) en dan hebben we het hydracide. Om het hydracide, HX (ac), te noemen, moet het achtervoegsel -ide van zijn watervrije vormen worden vervangen door het achtervoegsel -hydrisch. En ze moeten in de eerste plaats als zuren worden genoemd. Dus voor het bovenstaande voorbeeld wordt HI (ac) genoemd als: zuur jodiumhydric. Hydraciden kunnen worden gevormd door hun overeenkomstige waterstofhalogeniden eenvoudig in water op te lossen. Dit kan worden weergegeven door de volgende chemische vergelijking: HX (g) => HX (ac) HX (g) is zeer oplosbaar in water, dus er is geen evenwicht in oplosbaarheid, in tegenstelling tot de ionische dissociatie om zure protonen vrij te geven. Er is echter een synthetische methode die de voorkeur heeft omdat deze zouten of mineralen als grondstof gebruikt en deze bij lage temperaturen oplost met sterke zuren.. Als keukenzout, NaCl, wordt opgelost met geconcentreerd zwavelzuur, treedt de volgende reactie op: NaCl (s) + HtweeSW4(aq) => HCl (aq) + NaHSO4(ac) Zwavelzuur schenkt een van zijn zure protonen aan het chloride-anion Cl-, waardoor het wordt omgezet in zoutzuur. Waterstofchloride, HCl (g), kan uit dit mengsel ontsnappen omdat het erg vluchtig is, vooral als de concentratie in water erg hoog is. Het andere geproduceerde zout is natriumzuursulfaat, NaHSO4. Een andere manier om het te produceren is om zwavelzuur te vervangen door geconcentreerd fosforzuur: NaCl (s) + H3PO4(aq) => HCl (aq) + NaHtweePO4(ac) De H3PO4 reageert op dezelfde manier als HtweeSW4, het produceren van zoutzuur en natriumdizuurfosfaat. NaCl is de bron van het anion Cl-, zodat de andere hydraciden, zouten of mineralen die F bevatten, nodig zijn om de andere hydraciden te synthetiseren-, Br-, ik-, Stwee-, enz. Maar het gebruik van HtweeSW4 of H3PO4 het hangt af van zijn oxidatieve sterkte. De HtweeSW4 Het is een zeer sterk oxidatiemiddel, tot het punt dat het zelfs Br oxideert- en ik- tot hun moleculaire vormen Brtwee en iktweede eerste is een roodachtige vloeistof en de tweede een paarse vaste stof. Daarom is de H.3PO4 vertegenwoordigt het voorkeursalternatief in dergelijke syntheses. Hydraciden worden in wezen gebruikt om verschillende soorten materie op te lossen. Dit komt omdat het sterke zuren zijn en elk oppervlak met mate kunnen reinigen.. De zure protonen worden toegevoegd aan de verbindingen van onzuiverheden of vuil, waardoor ze oplosbaar worden in het waterige medium en vervolgens worden meegesleurd door het water. Afhankelijk van de chemische aard van het oppervlak, kan het ene of het andere hydracide worden gebruikt. Fluorwaterstofzuur kan bijvoorbeeld niet worden gebruikt om glas te reinigen, omdat het het ter plekke zal oplossen. Zoutzuur wordt gebruikt om vlekken van zwembadtegels te verwijderen. Ze zijn ook in staat om stenen of vaste monsters op te lossen en vervolgens te gebruiken voor analytische of productiedoeleinden op kleine of grote schaal. Bij ionenuitwisselingschromatografie wordt verdund zoutzuur gebruikt om de kolom van resterende ionen te reinigen.. Sommige reacties vereisen zeer zure oplossingen om ze te versnellen en de tijd dat ze plaatsvinden te verkorten. Dit is waar de hydraciden binnenkomen. Een voorbeeld hiervan is het gebruik van joodwaterstofzuur bij de synthese van ijsazijn. De olie-industrie heeft ook hydraciden nodig in raffinageprocessen. Hydraciden leveren niet alleen zure protonen, maar ook hun respectievelijke anionen. Deze anionen kunnen reageren met een organische of anorganische verbinding om een specifiek halogenide te vormen. Op deze manier kunnen ze worden gesynthetiseerd: fluoriden, chloriden, jodiden, bromiden, seleniden, sulfiden en andere verbindingen meer. Deze halogeniden kunnen zeer diverse toepassingen hebben. Ze kunnen bijvoorbeeld worden gebruikt om polymeren te synthetiseren, zoals Teflon; of tussenpersonen, van waaruit de halogeenatomen zullen worden opgenomen in de moleculaire structuren van bepaalde geneesmiddelen. Stel dat het molecuul CH3CHtweeOH, ethanol, reageert met HCl om ethylchloride te vormen: CH3CHtweeOH + HCl => CH3CHtweeCl + HtweeOF Elk van deze reacties verbergt een mechanisme en vele aspecten die in organische syntheses worden overwogen.. Er zijn niet veel voorbeelden beschikbaar voor hydraciden, aangezien het aantal mogelijke verbindingen natuurlijk beperkt is. Om deze reden worden hieronder enkele aanvullende hydraciden vermeld met hun respectieve nomenclatuur (de afkorting (ac) wordt genegeerd): Binaire hydracide waarvan de H-F-moleculen sterke waterstofbruggen vormen, tot het punt dat het in water een zwak zuur is. In tegenstelling tot de tot dan toe beschouwde hydraciden, is het polyatomisch, dat wil zeggen, het heeft meer dan twee atomen, maar het blijft binair omdat het uit twee elementen bestaat: zwavel en waterstof.. De hoekige H-S-H-moleculen vormen geen merkbare waterstofbruggen en kunnen worden gedetecteerd door hun karakteristieke geur van rotte eieren.. Een van de bekendste zuren in de populaire cultuur. Het maakt zelfs deel uit van de samenstelling van maagsap, aanwezig in de maag, en samen met spijsverteringsenzymen breken ze voedsel af. Net als joodwaterstofzuur bestaat het in de gasfase uit lineaire H-Br-moleculen, die uiteenvallen in H-ionen+ (H.3OF+) en Br- wanneer ze het water ingaan. Hoewel tellurium een bepaald metaalachtig karakter heeft, geeft zijn hydracide onaangename en zeer giftige dampen af, zoals waterstofselenide.. Net als de andere hydraciden van chalcogeniden (uit groep 16 van het periodiek systeem), produceert het in oplossing het anion Tetwee-, dus zijn valentie is -2.Nomenclatuur
Watervrije vorm
In waterige oplossing
Hoe worden ze gevormd?
Directe oplossing van waterstofhalogeniden
Oplossen van zouten van niet-metalen met zuren
Toepassingen
Reinigingsmiddelen en oplosmiddelen
Zure katalysatoren
Reagentia voor de synthese van organische en anorganische verbindingen
Voorbeelden
HF, fluorwaterstofzuur
H.tweeS, waterstofsulfide
HCl, zoutzuur
HBr, broomwaterstofzuur
H.tweeTe, tellurhydric zuur
Referenties


Niemand heeft nog op dit artikel gereageerd.