
Nikkel (III) hydroxide structuur, eigenschappen, gebruik, risico's

De nikkel (III) hydroxide Het is een anorganische verbinding waarbij nikkelmetaal een oxidatiegetal van 3+ heeft. De chemische formule is Ni (OH)3. Volgens de geraadpleegde bronnen was het tot nu toe niet mogelijk om het bestaan van nikkel (III) hydroxide Ni (OH)3, maar het is mogelijk geweest om nikkel (III) oxo-hydroxide, NiO (OH).
Nikkel (III) oxohydroxide NiO (OH) is een zwarte kristallijne vaste stof die kristalliseert in twee vormen: de bèta- en de gammavorm. De meest voorkomende kristallijne vorm van NiO (OH) is bèta.
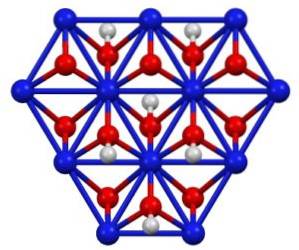
NiO (OH) kan worden verkregen door oxidatie van nikkel (II) nitraatoplossingen (Ni (NO3twee) met chloor (Cltwee) of broom (Brtwee) in aanwezigheid van kaliumhydroxide (KOH). Nikkel (III) oxohydroxide is goed oplosbaar in zuren. Het wordt toegepast in nikkelbatterijen, in supercondensatoren en als regenereerbare katalysator.
Nikkel (III) oxo-hydroxide NiO (OH) en nikkel (II) hydroxide Ni (OH)twee zijn verenigd in de werking van de meeste van hun toepassingen, aangezien beide deel uitmaken van dezelfde oxidatiereductievergelijking.
Omdat NiO (OH) een nikkelverbinding is, brengt het dezelfde risico's met zich mee als andere nikkelzouten, dat wil zeggen huidirritatie of dermatitis en kanker.
Artikel index
- 1 Kristalstructuur
- 2 Elektronische configuratie
- 3 Nomenclatuur
- 4 Eigenschappen
- 4.1 Fysieke toestand
- 4.2 Oplosbaarheid
- 4.3 Overige eigenschappen
- 5 toepassingen
- 5.1 In nikkelbatterijen
- 5.2 Bij elektrokatalyse als regenereerbare katalysator
- 5.3 In supercondensatoren
- 5.4 Bij oxidatie van metaalionen
- 6 Risico's
- 7 referenties
Kristal structuur
Nikkel (III) oxohydroxide kristalliseert in twee vormen: bèta en gamma. De bètavorm β-NiO (OH) heeft een vergelijkbare structuur als β-Ni (OH)twee, wat logisch lijkt, aangezien de eerste afkomstig is van de oxidatie van de laatste.
De gamma γ-NiO (OH) -vorm is het oxidatieproduct van nikkel (II) hydroxide in zijn alfavorm, α-Ni (OH)twee. Net als dat laatste heeft gamma een gelaagde structuur met alkalimetaalionen, anionen en water die tussen de lagen zijn gestrooid..
Elektronische configuratie
In NiO (OH) bevindt nikkel zich in de 3+ oxidatietoestand, wat betekent dat de buitenste lagen 3 elektronen missen, dat wil zeggen dat er twee elektronen ontbreken in laag 4s en een elektron uit schil 3d. De elektronenconfiguratie van Ni3+ in NiO (OH) is het: [Ar] 3d7, waarbij [Ar] de elektronenconfiguratie is van het edelgas argon.
Nomenclatuur
- NiO (OH): nikkel (III) oxohydroxide
- Nikkel zwart
Eigendommen
Fysieke toestand
Zwarte kristallijne vaste stof.
Oplosbaarheid
NiO (OH) oxohydroxide is zeer goed oplosbaar in zuren. De gamma-fase lost op in zwavelzuur met zuurstofontwikkeling.
Andere eigenschappen
In heet water wordt het nikkel (II) en (III) oxohydroxide, Ni3OFtwee(OH)4.
Het ontleedt bij 140 ºC in nikkel (II) oxide (NiO), water en zuurstof.
De gamma-fase (γ-NiO (OH)) kan op verschillende manieren worden verkregen, bijvoorbeeld door nikkel te behandelen met een gesmolten mengsel van natriumperoxide (NatweeOFtwee) en natriumhydroxide (NaOH) bij 600 ºC en koeling in ijswater.
De gammafase valt uiteen bij verhitting tot 138 ºC.
Toepassingen
In nikkelbatterijen
De nikkel-ijzerbatterij van Edison, waarin KOH wordt gebruikt als elektrolyt, is gebaseerd op de reactie van nikkel (III) oxohydroxide met ijzer:
Downloaden:
Fe + 2NiO (OH) + HtweeO ⇔ Fe (OH)twee + 2Ni (OH)twee
Laden:
Het is een omkeerbare oxidatie-reductiereactie.
Aan de anode van deze batterijen vindt een reeks chemische en elektrochemische processen plaats. Hier is een algemeen overzicht:
Downloaden
β-Ni (OH)twee ⇔ β-NiO (OH) + H+ + en-
Laden
Veroudering ↑ ↓ Overbelasting
Downloaden
α-Ni (OH)twee ⇔ γ-NiO (OH) + H+ + en-
Laden
In de technologie van nikkelbatterijen wordt nikkel (III) oxohydroxide NiO (OH) 'actieve nikkelmassa' genoemd.

Bij elektrokatalyse als regenereerbare katalysator
NiO (OH) is met succes gebruikt bij de elektrosynthese van azopyrazolen, door de elektrokatalytische oxidatie van aminopyrazolen. Het nut ervan bij de synthese van carbonzuren uitgaande van alcoholen of carbonylverbindingen is ook bewezen..

Een ander voorbeeld is de kwantitatieve omzetting van hydroxymethylpyridine in een pyridinecarbonzuur. In dit geval is de staal- of nikkelelektrode die overeenkomt met de anode bedekt met een laag NiO (OH). Het medium waarin de elektrolyse wordt uitgevoerd, is alkalisch.
Bij deze reacties fungeert NiO (OH) als een reductie-oxidatie-mediator, of "redox" -mediator..
De elektrolyse wordt uitgevoerd in een cel met nikkelanode en titaniumkathode, in een alkalisch medium. Ni (OH) wordt gevormd tijdens het procestwee op het oppervlak van de nikkelanode, die snel wordt geoxideerd tot NiO (OH):
Ni (OH)twee + Oh- - en- ⇔ NiO (OH) + HtweeOF
Het NiO (OH) reageert met het organische substraat en het gewenste organische product wordt verkregen, waarbij het Ni (OH)twee
NiO (OH) + organische verbinding → Ni (OH)twee + Product
Zoals Ni (OH) regenereerttwee, de katalyse-reactie wordt voortgezet.
Het gebruik van NiO (OH) als elektrokatalysator maakt het mogelijk organische verbindingen te verkrijgen tegen lage kosten en op een milieuvriendelijke manier.
In supercondensatoren
NiO (OH) samen met Ni (OH)twee maken uitstekende materialen voor supercondensatorelektroden. supercondensatoren.
Ni (OH)twee + Oh- ⇔ NiO (OH) + HtweeO + e-
Ze hebben een hoge capaciteit, lage kosten en, volgens sommige referenties, een lage impact op het milieu.

Ze hebben echter een lage geleidbaarheid. Dit wordt opgelost door nanodeeltjes van deze verbindingen te gebruiken, aangezien dit het oppervlak vergroot en de afstand die nodig is voor diffusie verkleint, wat zorgt voor een hoge overdrachtssnelheid van elektronen en / of ionen..
Bij oxidatie van metaalionen
Een van de commerciële toepassingen van nikkel (III) oxohydroxide is gebaseerd op het vermogen om kobalt (II) -ionen in oplossing tot kobalt (III) -ionen te oxideren..
Risico's
Nikkel in oplossing is stabieler dan Ni-iontwee+, daarom is het niet gebruikelijk om in contact te komen met Ni-oplossingen3+. De voorzorgsmaatregelen zijn echter dezelfde, aangezien nikkel, of het nu metallisch, in oplossing of in de vorm van vaste zouten is, huidsensibilisatie kan veroorzaken..
Het is raadzaam om beschermende uitrusting en kleding te gebruiken, zoals een gelaatsscherm, handschoenen en veiligheidsschoenen. Dit alles moet worden gebruikt wanneer de mogelijkheid bestaat om in contact te komen met nikkeloplossingen..
Als dermatitis optreedt, moet deze met een arts worden behandeld om uit te sluiten dat deze wordt veroorzaakt door nikkel..
Wat betreft de mogelijkheid van inademing, is het een goede gewoonte om de concentraties nikkelzoutstof in de lucht zeer laag te houden door middel van plaatselijke ventilatie en om indien nodig ademhalingsbescherming te gebruiken..
Alle nikkelverbindingen zijn geclassificeerd door het International Agency for Research on Cancer, of IARC. Internationaal Agentschap voor Kankeronderzoek), in de categorie kankerverwekkende stoffen voor mensen.
Dit is gebaseerd op epidemiologische en experimentele gegevens.
Referenties
- Cotton, F. Albert en Wilkinson, Geoffrey. (1980). Geavanceerde anorganische chemie. Vierde druk. John Wiley & Sons.
- Lyalin B.V. et al. Elektrosynthese van azopyrazolen via de oxidatie van N-alkylaminopyrazolen op een NiO (OH) anode in waterige alkali - Een groene methode voor N-N homokoppeling. Tetrahedron Letters. 59 (2018) 2741-2744. Opgehaald van sciencedirect.com.
- Liuyang, Zhang, et al. (2018). Op nikkel gebaseerde materialen voor supercondensatoren. Materialen vandaag. Opgehaald van sciencedirect.com
- Ettel, V.A. en Mosolu, M. A. (1977). Voorbereiding van nikkelzwart. ONS. Octrooi nr. 4.006.216. 1 februari 1977.
- Scharbert, B. (1993). Proces voor het oxideren van hydroxymethylpyridinederivaten tot pyridinecarbonzuurderivaten bij nikkeloxidehydroxideanodes. ONS. Octrooi nr. 5.259.933. 9 november 1993.
- Kirk-Othmer (1994). Encyclopedie van chemische technologie. Deel 17. Vierde editie. John Wiley & Sons.
- Ullmann's Encyclopedia of Industrial Chemistry. (1990). Vijfde editie. Deel A 17. VCH Verlagsgesellschaft mbH.
- McBreen, James. (1997). Nikkelhydroxiden. In Handbook of Battery Materials. VCH-uitgever. Opgehaald van osti.gov.


Niemand heeft nog op dit artikel gereageerd.