
Hydroxide-eigenschappen, nomenclatuur en voorbeelden

De hydroxiden zijn anorganische en ternaire verbindingen die bestaan uit de interactie tussen een metaalkation en de functionele groep OH (hydroxide anion, OH-De meeste zijn ionisch van aard, hoewel ze ook covalente bindingen kunnen hebben.
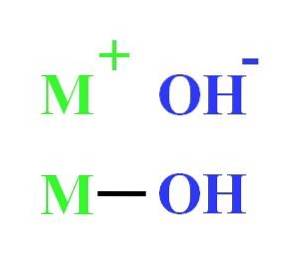
Een hydroxide kan bijvoorbeeld worden voorgesteld als de elektrostatische interactie tussen het kation M+ en het OH-anion-, of als de covalente binding door de M-OH-binding (onderste afbeelding). In de eerste vindt de ionische binding plaats, terwijl in de tweede de covalente is. Dit feit hangt hoofdzakelijk af van het metaal of kation M+, evenals zijn lading en ionenstraal.
Omdat de meeste van hen afkomstig zijn van metalen, staat het gelijk om ze als metaalhydroxiden te noemen.
Artikel index
- 1 Hoe worden ze gevormd?
- 2 Eigenschappen van hydroxiden
- 2.1 OH-anion-
- 2.2 Ionisch en basiskarakter
- 2.3 Periodieke trend
- 2.4 Amfoterie
- 2.5 Structuren
- 2.6 Uitdrogingsreactie
- 3 Nomenclatuur
- 3.1 Traditioneel
- 3.2 Voorraad
- 3.3 Systematiek
- 4 Voorbeelden van hydroxiden
- 5 referenties
Hoe worden ze gevormd?
Er zijn twee belangrijke syntheseroutes: door het overeenkomstige oxide te laten reageren met water, of met een sterke base in een zuur medium:
MO + HtweeO => M (OH)twee
MO + H+ + Oh- => M (OH)twee
Alleen die metaaloxiden die oplosbaar zijn in water reageren direct om het hydroxide te vormen (eerste chemische vergelijking). Andere zijn onoplosbaar en hebben zure soorten nodig om M. vrij te geven+, die dan in wisselwerking staat met de OH- van sterke basen (tweede chemische vergelijking).
Deze sterke basen zijn echter metaalhydroxiden NaOH, KOH en andere uit de groep van alkalimetalen (LiOH, RbOH, CsOH). Dit zijn ionische verbindingen die zeer goed oplosbaar zijn in water, vandaar hun OH- zijn vrij om deel te nemen aan chemische reacties.
Aan de andere kant zijn er metaalhydroxiden die onoplosbaar zijn en bijgevolg zeer zwakke basen. Sommige zijn zelfs zuur, zoals het geval is met telluurzuur, Te (OH)6.
Het hydroxide brengt een oplosbaarheidsevenwicht tot stand met het omringende oplosmiddel. Is het bijvoorbeeld water, dan wordt het evenwicht als volgt uitgedrukt:
M (OH)twee <=> M.twee+(ac) + OH-(ac)
Waar (ac) aangeeft dat het medium waterig is. Als de vaste stof onoplosbaar is, is de opgeloste OH-concentratie klein of verwaarloosbaar. Om deze reden kunnen onoplosbare metaalhydroxiden geen zo basische oplossingen genereren als NaOH..
Uit het bovenstaande kan worden afgeleid dat hydroxiden zeer verschillende eigenschappen vertonen, gekoppeld aan de chemische structuur en de interacties tussen metaal en OH. Dus hoewel vele ionisch zijn, met gevarieerde kristallijne structuren, hebben andere complexe en ongeordende polymere structuren..
Eigenschappen van hydroxiden
OH anion-
Het hydroxylion is een zuurstofatoom covalent gebonden aan waterstof. Dit kan dus gemakkelijk worden weergegeven als OH-. De negatieve lading bevindt zich op de zuurstof, waardoor dit anion een elektronendonorsoort is: een basis.
Als het OH- schenkt zijn elektronen aan een waterstof, wordt een H-molecuul gevormdtweeO. Je kunt je elektronen ook doneren aan positief geladen soorten: zoals metaalcentra M+. Er wordt dus een coördinatiecomplex gevormd door de datieve M-OH-binding (zuurstof levert het elektronenpaar).
Om dit te laten gebeuren, moet de zuurstof echter efficiënt kunnen coördineren met het metaal, anders zullen de interacties tussen M en OH een duidelijk ionisch karakter hebben (M+ Oh-Omdat het hydroxylion in alle hydroxiden hetzelfde is, ligt het verschil tussen alle hydroxiden in het kation dat ermee gepaard gaat.
Evenzo, omdat dit kation van elk metaal op het periodiek systeem kan komen (groepen 1, 2, 13, 14, 15, 16 of de overgangsmetalen), variëren de eigenschappen van dergelijke hydroxiden enorm, hoewel ze allemaal een aantal aspecten gemeen hebben..
Ionisch en basiskarakter
In hydroxiden hebben ze, hoewel ze coördinatiebindingen hebben, een latent ionisch karakter. In sommige, zoals NaOH, maken hun ionen deel uit van een kristalrooster dat bestaat uit Na-kationen+ en OH-anionen- in verhoudingen 1: 1; dat wil zeggen voor elk Na-ion+ er is een OH-ion- tegenhanger.
Afhankelijk van de lading van het metaal zullen er meer of minder OH-anionen zijn- eromheen. Bijvoorbeeld voor een metaalkation Mtwee+ er zullen twee OH-ionen zijn- interactie met hem: M (OH)twee, wat wordt geschetst als HO- M.twee+ Oh-. Op dezelfde manier gebeurt het met de metalen M3+ en met anderen met meer positieve ladingen (hoewel ze zelden meer dan 3+ zijn).
Dit ionische karakter is verantwoordelijk voor veel van de fysische eigenschappen, zoals smelt- en kookpunten. Deze zijn hoog en weerspiegelen de elektrostatische krachten die in het kristalrooster aan het werk zijn. Evenzo, wanneer hydroxiden oplossen of smelten, kunnen ze elektrische stroom geleiden vanwege de mobiliteit van hun ionen..
Niet alle hydroxiden hebben echter dezelfde kristalroosters. Degenen met de meest stabiele zullen minder snel oplossen in polaire oplosmiddelen zoals water. Als algemene regel geldt dat hoe meer ongelijk de ionstralen van M+ en OH-, meer oplosbaar zal hetzelfde zijn.
Periodieke trend
Dit verklaart waarom de oplosbaarheid van alkalimetaalhydroxiden toeneemt naarmate men zich lager in de groep bevindt. De oplopende volgorde van oplosbaarheid in water hiervoor is dus als volgt: LiOH De OH- is een klein anion, en naarmate het kation volumineuzer wordt, verzwakt het kristalrooster energetisch. Aan de andere kant vormen aardalkalimetalen minder oplosbare hydroxiden vanwege hun hogere positieve ladingen. Dit komt doordat de Mtwee+ trekt OH sterker aan- vergeleken met M+. Evenzo zijn de kationen ervan kleiner en daarom minder ongelijk in grootte met betrekking tot OH-. Het resultaat hiervan is experimenteel bewijs dat NaOH veel basischer is dan Ca (OH).twee. Dezelfde redenering kan worden toegepast voor andere hydroxiden, hetzij voor die van de overgangsmetalen, hetzij voor die van de p-blokmetalen (Al, Pb, Te, enz.). Ook hoe kleiner en groter de ionenstraal en de positieve lading van M+, hoe lager het ionische karakter van het hydroxide, met andere woorden, die met zeer hoge ladingsdichtheden. Een voorbeeld hiervan doet zich voor met berylliumhydroxide, Be (OH)twee. Hij istwee+ het is een heel klein kation en door zijn tweewaardige lading is het elektrisch zeer dicht. Hydroxiden M (OH)twee reageren met zuren om een waterig complex te vormen, dat wil zeggen M+ eindigt omringd door watermoleculen. Er is echter een beperkt aantal hydroxiden die ook kunnen reageren met basen. Dit zijn zogenaamde amfotere hydroxiden. Amfotere hydroxiden reageren met zowel zuren als basen. De tweede situatie kan worden weergegeven door de volgende chemische vergelijking: M (OH)twee + Oh- => M (OH)3- Maar hoe bepaal je of een hydroxide amfoteer is? Door middel van een eenvoudig laboratoriumexperiment. Omdat veel metaalhydroxiden onoplosbaar zijn in water, wordt een sterke base toegevoegd aan een oplossing met de M-ionen+ opgelost, bijvoorbeeld Al3+, het overeenkomstige hydroxide zal neerslaan: Naar de3+(aq) + 3OH-(ac) => Al (OH)3(s) Maar met een teveel aan OH- het hydroxide blijft reageren: Al (OH)3(s) + OH- => Al (OH)4-(ac) Als gevolg hiervan wordt het nieuwe negatief geladen complex gesolvateerd door de omringende watermoleculen, waardoor de witte vaste stof van aluminiumhydroxide wordt opgelost. Die hydroxiden die onveranderd blijven met de extra toevoeging van base, gedragen zich niet als zuren en zijn daarom niet amfoteer. Hydroxiden kunnen kristallijne structuren hebben die lijken op die van veel zouten of oxiden; sommige eenvoudig en andere erg complex. Bovendien kunnen die met een afname van het ionische karakter metaalcentra vertonen die zijn verbonden door zuurstofbruggen (HOM-O-MOH). In oplossing zijn de structuren verschillend. Hoewel het voor sterk oplosbare hydroxiden voldoende is om ze te beschouwen als in water opgeloste ionen, is het voor andere noodzakelijk om rekening te houden met de coördinatiechemie. Dus elk kation M+ het kan worden afgestemd op een beperkt aantal soorten. Hoe omvangrijker het is, hoe groter het aantal moleculen water of OH.- eraan gekoppeld. Van hieruit komt de beroemde coördinatie-octaëder van vele metalen opgelost in water (of een ander oplosmiddel): M (OHtwee6+n, waarbij n gelijk is aan de positieve lading van het metaal. Cr (OH)3, het vormt bijvoorbeeld in feite een octaëder. Hoe? Beschouw de verbinding als [Cr (OHtwee3(OH)3], waarvan drie van de watermoleculen zijn vervangen door OH-anionen-. Als alle moleculen zijn vervangen door OH-, dan het complex met negatieve lading en octaëdrische structuur [Cr (OH)63-. De -3 lading is het resultaat van de zes negatieve ladingen van de OH-. Hydroxiden kunnen worden beschouwd als "gehydrateerde oxiden". In hen staat "water" echter in direct contact met M+terwijl in de gehydrateerde oxiden MO nHtweeOf, de watermoleculen maken deel uit van een externe coördinatiesfeer (ze bevinden zich niet dicht bij het metaal). Deze watermoleculen kunnen worden geëxtraheerd door een monster hydroxide te verwarmen: M (OH)twee + Q (warmte) => MO + HtweeOF MO is het metaaloxide dat wordt gevormd als gevolg van de uitdroging van het hydroxide. Een voorbeeld van deze reactie is de reactie die wordt waargenomen wanneer cuprihydroxide, Cu (OH), wordt gedehydrateerdtwee Cu (OH)twee (blauw) + Q => CuO (zwart) + HtweeOF Wat is de juiste manier om hydroxiden te noemen? De IUPAC stelde hiervoor drie nomenclaturen voor: de traditionele, de voorraad en de systematische. Het is correct om een van de drie te gebruiken, maar voor sommige hydroxiden kan het handiger of praktischer zijn om het op de een of andere manier te noemen. De traditionele nomenclatuur is simpelweg het achtervoegsel -ico toe te voegen aan de hoogste valentie van het metaal; en het achtervoegsel -oso tot de laagste. Als het metaal M dus valenties +3 en +1 heeft, is hydroxide M (OH)3 het wordt hydroxide (metaalnaam) genoemdico, terwijl MOH hydroxide (metaalnaam)beer. Om de valentie van het metaal in het hydroxide te bepalen, kijkt u gewoon naar het getal achter de OH tussen haakjes. Dus M (OH)5 betekent dat het metaal een lading of valentie heeft van +5. Het belangrijkste nadeel van deze nomenclatuur is echter dat het gecompliceerd kan zijn voor metalen met meer dan twee oxidatietoestanden (zoals chroom en mangaan). In dergelijke gevallen worden de voorvoegsels hyper- en hypo- gebruikt om de hoogste en laagste valenties aan te duiden.. Dus als M in plaats van alleen +3 en +1 valenties heeft, het ook +4 en +2 heeft, dan zijn de namen van de hydroxiden met de hoogste en laagste valenties: hydroxide hyper(metalen naam)ico, en hydroxide hik(metalen naam)beer. Van alle nomenclaturen is dit de eenvoudigste. Hier wordt de naam van het hydroxide eenvoudigweg gevolgd door de valentie van het metaal tussen haakjes en geschreven in Romeinse cijfers. Nogmaals voor de M (OH)5, uw voorraadnomenclatuur zou bijvoorbeeld zijn: (metaalnaam) hydroxide (V). (V) geeft dan aan (+5). Ten slotte wordt de systematische nomenclatuur gekenmerkt door zijn toevlucht te nemen tot vermenigvuldigende voorvoegsels (di-, tri-, tetra-, penta-, hexa-, enz.). Deze voorvoegsels worden gebruikt om zowel het aantal metaalatomen als OH-ionen te specificeren.-. Op deze manier wordt de M (OH)5 genoemd als: (metaalnaam) pentahydroxide. In het geval van Hgtwee(OH)twee, het zou bijvoorbeeld dimercuric dihydroxide zijn; een van de hydroxiden waarvan de chemische structuur op het eerste gezicht complex is. Enkele voorbeelden van hydroxiden en hun overeenkomstige nomenclaturen zijn als volgt: -NaOH (natriumhydroxide) -Ca (OH) 2 (calciumhydroxide) -Fe (OH)3. (IJzerhydroxide; ijzer (III) hydroxide; of ijzertrihydroxide) -V (OH)5 (Pervanadisch hydroxide; Vanadium (V) hydroxide; of vanadiumpentahydroxide). -Sn (OH)4 (Stanic hydroxide; tin (IV) hydroxide; of tin-tetrahydroxide). -Ba (OH)twee (Bariumhydroxide of bariumdihydroxide). -Mn (OH)6 (Mangaanhydroxide, mangaan (VI) hydroxide of mangaanhexahydroxide). -AgOH (zilverhydroxide, zilverhydroxide of zilverhydroxide). Merk op dat er voor deze verbinding geen onderscheid is tussen de voorraad en de systematische nomenclaturen. -Pb (OH)4 (Loodhydroxide, lood (IV) hydroxide of loodtetrahydroxide). -LiOP (lithiumhydroxide). -Cd (OH) 2 (cadmiumhydroxide) -Ba (OH)twee (Bariumhydroxide) -ChroomhydroxideAmfoterie
Structuren
Uitdrogingsreactie
Nomenclatuur
Traditioneel
Voorraad
Systematisch
Voorbeelden van hydroxiden


Referenties



Niemand heeft nog op dit artikel gereageerd.