
Immunoglobuline D-structuur, functie en normale waarden

De immunoglobuline D (IgD), ontdekt in 1965, is een oppervlakte-immunoglobuline dat (samen met IgM) wordt aangetroffen in het membraan van B-lymfocyten (mIgD) voordat ze worden geactiveerd.
Het heeft zijn functie als de initiële receptor voor antigenen. IgD is ook vrij in plasma dankzij zijn secretie (sIgD). Het heeft een molecuulgewicht van 185.000 Dalton en vertegenwoordigt ongeveer 1% van de immunoglobulinen in een organisme.
Artikel index
- 1 Wat zijn immunoglobulinen?
- 2 Structuur
- 3 Functie en ziekten
- 3.1 sIgD
- 3,2 mIgD
- 3.3 B-lymfocyten
- 3.4 Immuunsysteem
- 4 Normale waarden
- 4.1 Serumconcentratie
- 4.2 Bloedwaarden
- 5 referenties
Wat zijn immunoglobulinen?
Immunoglobulines of antilichamen zijn zeer specifieke complexe globulaire glycoproteïnen die worden gesynthetiseerd door B-lymfocyten, cellen die verantwoordelijk zijn voor de immuunrespons in het lichaam van dieren..
Immunoglobulinen werken samen met moleculen die het lichaam identificeert als niet-zelf of antigenen. Elke stof die de immuunrespons in het lichaam kan activeren, wordt een antigeen genoemd..
De familie van Ig-antilichaammoleculen omvat de moleculen die in bloedplasma circuleren en die op het oppervlak van B-lymfocyten voorafgaand aan hun activering..
Er zijn vijf soorten immunoglobulinen: IgG, IgD, IgE, IgA en IgM (geïdentificeerd bij onder meer mensen, muizen, honden, reptielen, vissen), die structureel verschillen door hun constante gebieden in de zware keten. Deze verschillen geven ze bijzondere functionele eigenschappen.
Antilichamen werken als specifieke sensoren voor antigenen. Hiermee vormen ze complexen die een cascade van reacties op gang brengen die typisch zijn voor het immuunsysteem. De algemene fasen in dit proces zijn: herkenning, differentiatie van specifieke lymfocyten en tenslotte het effectorstadium.
Structuur
Alle antilichamen zijn complexe polypeptidemoleculen in de vorm van een "Y". Ze zijn opgebouwd uit vier polypeptideketens, waarvan twee identieke lichte (korte) ketens van elk ongeveer 214 aminozuren, en de andere twee zware (lange) ketens ook identiek aan elkaar, twee keer zoveel aminozuren. Een disulfidebinding verbindt een lichte keten met een zware keten.
Beide soorten ketens hebben constante gebieden (kenmerkend voor het type antilichaam en de soort waartoe het organisme behoort), waar de sequentie van aminozuren wordt herhaald van het ene molecuul naar het andere, en ze hebben ook variabele gebieden van ongeveer 100 aminozuren in lengte..
Een disulfidebrug (binding van het covalente type) verbindt elke lichte keten met een zware keten en op hun beurt kunnen een of twee van deze bindingen de twee zware ketens verbinden.
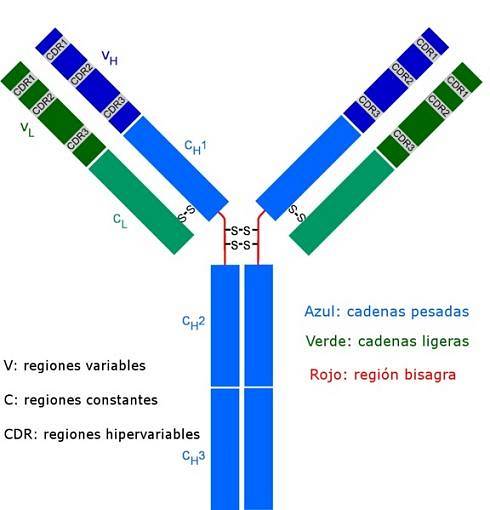
Dit zijn sites die als een handschoen aan een bepaald gebied van het specifieke antigeen, epitoop of antigene determinant binden. De stabilisatie van deze interactie vindt plaats dankzij talrijke niet-covalente bindingen.
Deze CDR-sequenties zijn zeer variabel tussen antilichamen en genereren specificiteit voor verschillende soorten antigenen..
Wat betreft de bijzonderheden van immunoglobuline D, is het bekend dat het een grote diversiteit vertoont onder gewervelde dieren. In grote lijnen bestaat het uit twee zware delta-ketens en twee lichte ketens. IgD is ofwel vrij in serum of gebonden aan B-lymfocyten via een Fc-receptor..
Functie en ziekten
Aangezien IgD evolutionair is bewaard gebleven van kraakbeenachtige vissen (die de planeet ongeveer 500 miljoen jaar geleden bevolkten) voor mensen, wordt aangenomen dat het vitale immuunfuncties dient.
Desondanks is het de minst bestudeerde immunoglobuline, waarvoor de specifieke functies van sIgD in serum nog niet precies bekend zijn, terwijl verschillende functies zijn voorgesteld voor mIgD..
sIgD
Een van de oorzaken van de recente belangstelling voor de studie van sIgD is de vondst van hoge niveaus van dit Ig bij sommige kinderen met periodieke koorts. Een andere interessante factor is op zijn beurt het nut ervan bij het volgen van myelomen..
Aangenomen wordt dat SIgD een rol speelt in het bloed, slijmvliesafscheidingen en op het oppervlak van aangeboren immuuneffectorcellen, zoals basofielen..
Ze zijn zeer reactief tegen pathogenen van het ademhalingssysteem en hun uitscheidingsproducten. Van IgD is gemeld dat het de mucosale immuniteit verhoogt, dankzij het effect op aanwezige bacteriën en virussen.
mIgD
Met betrekking tot mIgD wordt het beschouwd als een membraanantigeenreceptor voor B-lymfocyten, wat de celrijping zou bevorderen. Op zijn beurt wordt aangenomen dat het een ligand is voor IgD-receptoren bij de immunoregulatie van T-helpercellen..
B-lymfocyten
Aangenomen wordt dat IgD-producerende B-lymfocyten een bepaalde cellijn vertegenwoordigen die B-1-lymfocyten worden genoemd. Dit zijn zelfreactieve lymfocyten die aan de klonale deletie zijn ontsnapt.
De auto-antilichamen die door deze lymfocyten worden gegenereerd, reageren met deoxyribonucleïnezuur of DNA (enkel- en dubbelstrengs), met celreceptoren, de celmembranen van rode bloedcellen en epitheelweefsel..
Dit is hoe ze auto-immuunziekten genereren, zoals systemische lupus erythematosus, myasthenie Gravis, auto-immuun hemolytische anemie en idiopathische trombocytopenie purpura.
Immuun-ontstekingssysteem
Het is ook bekend dat IgD's betrokken zijn bij de orkestratie van een systeem dat interfereert tussen het immuunsysteem en het ontstekingssysteem: hoge concentraties IgD zijn gerelateerd aan auto-inflammatoire aandoeningen (hyperimmunoglobulemiesyndroom D, HIDS of hyper-IgD).
Bij patiënten met auto-immuunziekten, zoals reumatoïde artritis, worden bijvoorbeeld verhoogde waarden van zowel sIgD als mIgD gevonden. Daarom wordt aangenomen dat deze aandoening bijdraagt aan de pathogenese van de ziekte.
De mogelijke functies van dit antilichaam in mononucleaire cellen uit perifeer bloed (PBMC) van deze patiënten worden momenteel bestudeerd. Dit alles heeft ertoe geleid dat IgD een potentieel immunotherapeutisch doelwit zou kunnen zijn bij de behandeling van reumatoïde artritis..
Normale waarden
De sIgD bij normale individuen varieert sterk, waardoor het moeilijk is om een nauwkeurig referentie-interval vast te stellen voor hun normale concentraties. Sommige onderzoeken hebben aangetoond dat deze variatie vooral wordt beïnvloed door:
- De gevoeligheid van de toegepaste detectietechniek - zowel door middel van radioimmunoassays (RIA), enzymimmunoassays (EIA) en de meest gebruikte in klinische laboratoria, namelijk radioimmunodiffusie (RID)-.
- De afwezigheid van een enkele voorgeschreven universele methode voor de detectie van IgD.
- Erfelijke factoren, ras, leeftijd, geslacht, zwangerschapsstatus, rookstatus, onder andere
Sommige specialisten zijn zelfs van mening dat de routinematige analyse van IgD niet gerechtvaardigd is, omdat de specifieke rol ervan verre van opgehelderd is en de kosten van de analyse ervan in het klinische laboratorium hoog zijn. Het zou alleen gerechtvaardigd zijn in gevallen van patiënten met monoklonaal IgD in het serum of waarvan wordt vermoed dat ze HIDS hebben.
Serum concentratie
Aan de andere kant is bekend dat sIgD in het algemeen een serumconcentratie heeft die lager is dan die van IgG, IgA en IgM, maar hoger dan de concentratie van IgE..
Bovendien, omdat het een halfwaardetijd heeft van 2 tot 3 dagen, is de plasmaconcentratie minder dan 1% van de totale immunoglobuline in serum. Sommige onderzoeken geven aan dat het 0,25% van de totale serumimmunoglobulinen vertegenwoordigt.
Bloedwaarden
Onder de gerapporteerde waarden van sIgD in bloed was het bij pasgeborenen 0,08 mg / l (bepaald door RIA), bij zuigelingen en volwassenen varieert het van niet-detecteerbare waarden tot 400 mg / l (afhankelijk van de leeftijd en het individu van elk individueel).
Bij normale volwassenen zijn ze gerapporteerd als normale gemiddelden 25; 35; 40 en 50 mg / L. In algemene termen is de gemiddelde serumconcentratie voor gezonde volwassenen gerapporteerd als 30 mg / l (bepaald door RID)..
Zoals in dit artikel wordt besproken, zijn er echter tal van factoren die het vaststellen van een reeks normale standaardwaarden verhinderen..
Referenties
- Chen, K. en Cerutti, A. (2011). De functie en regulering van immunoglobuline D. Huidige mening in immunologie, 23 (3), 345-52.
- Harfi, A. H. en Godwin, J.T. (1985). Normale serumniveaus van IgG, IgA, IgM, IgD en IgE in Saoedi-Arabië. Annals of Saudi Medicine, Vol 5, No. 2.99-104. doi: 10.5144 / 0256-4947.1985.99
- Josephs, S.H. en Buckley, R.H. (1980). Serum-IgD-concentraties bij normale zuigelingen, kinderen en volwassenen en bij patiënten met verhoogd IgE. The Journal of Pediatrics, Vol. 96, nr. 3, blz. 417-420.
- Vladutiu, A.O. (2000). Immunoglobuline D: eigenschappen, meting en klinische relevantie. Klinische en diagnostische laboratoriumimmunologie, 7(2), 131-40.
- Voet, J.G. en Voet, W.P.D. (2005). Fundamentals of Biochemestry: Lyfe op moleculair niveau. Wiley. pp 1361.
- Wu, Y., Chen, W., Chen, H., Zhang, L., Chang, Y., Yan, S., Dai, X., Ma, Y., Huang, Q. en Wei, W. ( 2016). De verhoogde uitgescheiden immunoglobuline D versterkte de activering van mononucleaire cellen uit perifeer bloed bij reumatoïde artritis. PloS één, 11 (1). doi: 10.1371 / journal.pone.0147788



Niemand heeft nog op dit artikel gereageerd.